- Информация об обществе
- Общая информация
- Президиум РОИБ
- Комитеты РОИБ
- Региональные отделения РОИБ
- Секция молодых ученых
- Регистрация в РОИБ
- Конференции
- Российские конференции
- Международные конференции
- Архив российских конференций
- Регистрация на конференцию РОИБ
- Регистрация на вебинары
- Условия НМО
- Образовательные программы
- Клинические рекомендации
- Специалистам
- Справочные материалы и руководства
- Послеоперационная боль
- Организация противоболевой помощи
- Фундаментальные аспекты боли
- Мигрень
- Головные и лицевые боли
- Невропатические боли
- Боль в спине
- Висцеральная боль
- Болевые синдромы в онкологической практике
- Боль в гематологии
- Этика боли
- Ссылки на полезные источники информации
- Опросники и шкалы для оценки боли
- Профилактика боли
- Центры, клиники и кабинеты по лечению и изучению боли
- В помощь пациенту
- Контакты
Курс 1. ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ БОЛИ
Курс 1. ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ БОЛИ
Патофизиология боли 5 / 5Все болевые синдромы можно условно разделить на три основные группы: ноцицептивные, невропатические и психогенные боли. В реальной жизни эти патофизиологические варианты болевых синдромов часто сосуществуют.
Ноцицептивные болевые синдромы возникают вследствие активации ноцицепторов при травме, воспалении, ишемии, отеке тканей. Клинически среди них выделяют: посттравматический и послеоперационный болевые синдромы, боли при воспалении суставов, миофасциальные болевые синдромы, сосудистые боли, боли у онкологических больных, стенокардические боли, боли при желчнокаменной болезни и др.
Как правило, при повреждении поверхностных тканей пациенты испытывают острую боль. В случае вовлечения в патологический процесс мышц или костей возникает ощущение тупой, ноющей боли. Эта боль усиливается при движении и ослабевает в покое. Соматическая боль обычно хорошо локализована и четко ощущается в зоне поражения. Боль, возникающая при повреждении висцеральных органов, обычно плохо локализована, т. к передается преимущественно посредством С-волокон и воспринимается как глубокая, сжимающая, схваткообразная. Она может сочетаться с тошнотой, рвотой, изменением частоты сердцебиения и глубины дыхания, сопровождаться обильным потоотделением. При патологии висцеральных органов наряду с глубокой болью появляются зоны отраженной боли (зоны Геда--Захарьина).
Наряду с жалобами на постоянную болезненность, у пациентов с ноцицептивной болью формируются зоны с повышенной болевой чувствительностью (зоны гипералгезии).
Выделяют первичную и вторичную гипералгезию. Первичная гипералгезия развивается в области поврежденных тканей, вторичная -- локализуется вне зоны повреждения, распространяясь на здоровые ткани. В основе развития первичной гипералгезии лежит феномен периферической сенситизации (повышение чувствительности ноцицепторов к действию повреждающих стимулов). Вторичная гипералгезия возникает в результате центральной сенситизации (повышения возбудимости в первую очередь ноцицептивных нейронов задних рогов спинного мозга).
Сенситизация ноцицепторов возникает вследствие действия альгогенов, поступающих из плазмы крови, выделяющихся из поврежденной ткани, а также из периферических терминалей С-ноцицепторов. Нейропептиды С-ноцицепторов обладают провоспалительным эффектом и, выделяясь при активации С-ноцицепторов, приводят к развитию «нейрогенного воспаления», вызывая расширение сосудов и увеличение их проницаемости. Кроме того, они способствуют высвобождению из тучных клеток и лейкоцитов простагландинов, цитокинов и биогенных аминов, которые в свою очередь, воздействуя на свободные нервные окончания ноцицепторов, повышают их возбудимость.
Приведенные механизмы повышения возбудимости характерны для всех типов ноцицепторов, локализованных в любой ткани, и развитие первичной гипералгезии отмечается не только в коже, но и в мышцах, суставах, костях и внутренних органах.
Ведущим механизмом сенситизации центральных ноцицептивных нейронов является длительное деполяризующее влияние глутамата и нейрокининов на ноцицептивные нейроны заднего рога. Последние годы ознаменовались также открытием важной роли в этом процессе иммунных и глиальных клеток и выделяемых ими цитокинов, хемокинов и факторов роста. Помимо сенситизации ноцицептивных нейронов заднего рога, повреждение тканей инициирует повышение возбудимости ноцицептивных нейронов и в вышележащих центрах, включая ядра таламуса и соматосенсорную кору больших полушарий.
Весьма существенным фактором в усугублении ноцицептивной боли является рефлекторное напряжение мышц. Доказано, что повышение возбудимости ноцицептивных нейронов в структурах ЦНС неминуемо вызывает рефлекторную активацию мотонейронов передних рогов в соответствующих сегментах спинного мозга и тоническое сокращение мышц. Длительное напряжение ухудшает кровоснабжение мышечной ткани, в ней возникает гипоксия, ацидоз, происходит выделение брадикинина, появляются метаболиты арахидоновой кислоты и биогенные амины. Эти медиаторы воспаления, связываясь с соответствующими рецепторами на мембране периферических окончаний мышечных ноцицепторов, сенситизируют их. Появляются локусы болезненных мышечных уплотнений, что еще больше усиливает афферентный поток ноцицептивных импульсов в задние рога спинного мозга и другие отделы ЦНС, и, как следствие, повышается возбудимость центральных ноцицептивных нейронов. Мышечный спазм становится не только дополнительным источником боли, но и формирует порочный круг, обеспечивающий хронизацию соматогенного болевого синдрома.
Таким образом, периферическое повреждение запускает целый каскад патофизиологических процессов, затрагивающих всю ноцицептивную систему от тканевых рецепторов до корковых нейронов, вызывая в них стойкие изменения возбудимости, которые проявляются повышением болевой чувствительности.
Выраженность и продолжительность периферической и центральной сенситизации при ноцицептивной боли напрямую зависит от характера и продолжительности повреждения тканей. В случаях заживления ткани будет также исчезать феномен периферической и центральной сенситизации, и наоборот, чем дольше будет сохраняться повреждение и воспаление, тем длительнее будет болевое ощущение. Например, у пациентов с дегенеративными поражениями суставов прогрессирование заболевания будет сопровождаться и увеличением продолжительности боли.
Невропатические боли, по определению экспертов Международной ассоциации по изучению боли, являются следствием первичного повреждения или дисфункции нервной системы, однако на II Международном конгрессе по невропатической боли (2007 г.) в определение было предложено внести изменения, согласно которому, к невропатической боли относят боль, возникающую вследствие прямого повреждения или болезни соматосенсорной системы. Невропатическая боль может возникнуть как при повреждении периферической нервной системы, так и центральных структур соматосенсорного анализатора. Причинами повреждения периферической нервной системы могут быть метаболические нарушения, травма, интоксикации, инфекционный процесс, механическое сдавление, авитаминозы. Причинами возникновения невропатической боли при повреждении структур ЦНС (такие болевые синдромы также называют центральными болями) считают травмы спинного и головного мозга, ишемические и геморрагические инсульты, приводящие к дефициту соматосенсорной чувствительности, демиелинизирующие заболевания (рассеянный склероз), сирингомиелия, боли при болезни Паркинсона и др. Наиболее часто невропатические боли встречаются в виде болевой диабетической полиневропатии и постгерпетической невралгии. С болевыми полиневропатиями сталкиваются не только неврологи, данная патология часто наблюдаются у ревматологических больных с узелковым периартериитом, ревматоидным артритом, системной красной волчанкой. Не менее трети онкологических больных страдают невропатической болью вследствие прорастания опухоли в нервных структурах, повреждения нервов при химиотерапии, лучевой терапии или обширных оперативных вмешательствах.
Патофизиологической основой невропатических болевых синдромов являются нарушения механизмов генерации и проведения ноцицептивного сигнала в нервных волокнах и процессов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга. Повреждение нервов приводит к структурно-функциональным преобразованиям в нервном волокне: увеличивается количество натриевых каналов на мембране нервного волокна, обеспечивающих формирование возбуждающих потенциалов, появляются новые нетипичные рецепторы и зоны генерации эктопической импульсации (дополнительные локусы возникновения потенциалов действия), нервное волокно становится чувствительным к механическим воздействиям, создаются условия для перекрестного возбуждения нейронов ганглия заднего корешка. Все это формирует неадекватную реакцию нервного волокна на раздражение, способствуя существенному изменению паттерна передаваемого сигнала. Возникают такие симптомы, как дизестезия, парестезия, гиперпатия. Усиленная импульсация с периферии дезорганизует работу и центральных структур: происходит сенситизация ноцицептивных нейронов, гибель тормозных интернейронов, инициируются нейропластические процессы, приводящие к новым межнейронным контактам тактильных и ноцицептивных афферентов, повышается эффективность синаптической передачи. Такая реорганизация приводит к появлению спонтанной боли, механической и температурной аллодинии. В результате легкие тактильные стимулы (например, прикосновение постельного белья или одежды) воспринимаются пациентом как боль. Одновременно с повышением возбудимости нейронов повреждение периферических нервов приводит к гибели части ноцицептивных нейронов и тормозных интернейронов в структурах спинного и головного мозга. Гибель нейронов в этих условиях обусловлена чрезмерным выбросом в синаптическую щель глутамата и нейрокининов, в избыточных концентрациях обладающих цитотоксическим действием. Гибель нейронов вследствие "глутаматного удара" наблюдается не только в задних рогах спинного мозга, но и в ядрах зрительных бугров и соматосенсорной коре больших полушарий. Несколько морфометрических и биохимических исследований выявили атрофию серого вещества в дорсолатеральных отделах префронтальной коры и в таламусе, выраженность которой коррелировала с длительностью хронической боли в спине. Исследования, проведенные у пациентов с комплексным регионарным болевым синдромом, показали, что атрофия серого вещества головного мозга нарастает практически ступенеобразно по мере прогрессирования заболевания в его первые шесть месяцев. Замещение погибших нейронов при транссинаптической дегенерации клетками глии способствует возникновению устойчивой деполяризации сохранившихся нейронов и повышению их возбудимости.
Однако повреждение периферических и центральных структур соматосенсорной системы не может рассматриваться в качестве непосредственной самостоятельной причины возникновения невропатической боли, а является лишь предрасполагающим фактором. Основанием для подобных рассуждений служат данные, свидетельствующие о том, что невропатическая боль возникает далеко не всегда, даже при наличии клинически подтвержденного повреждения структур соматосенсорного анализатора. Так, перерезка седалищного нерва приводит к появлению болевого поведения только у 40-70% крыс. Повреждение спинного мозга с симптомами гипалгезии и температурной гипестезии сопровождается центральными болями у 30% пациентов. Не более 8% больных, перенесших мозговой инсульт с дефицитом соматосенсорной чувствительности, испытывают невропатические боли. Постгерпетическая невралгия в зависимости от возраста пациентов развивается у 27-70% больных, перенесших опоясывающий лишай. Невропатическая боль у пациентов с клинически верифицированной сенсорной диабетической полиневропатией отмечается в 18-35% случаев. И, наоборот, в 8% случаев у пациентов с сахарным диабетом присутствует клиническая симптоматика невропатической боли при отсутствии признаков сенсорной полиневропатии. Учитывая также, что выраженность болевой симптоматики и степень нарушений чувствительности у подавляющего большинства пациентов с невропатиями не взаимосвязаны, можно полагать, что для развития невропатической боли недостаточно наличия повреждения соматосенсорной нервной системы, а требуется ряд условий, приводящих к нарушению интегративных процессов в сфере системной регуляции болевой чувствительности. Иными словами, у ряда индивидуумов изначально может существовать предрасположенность к развитию устойчивых патологических состояний, которая в случае повреждения структур соматосенсорной нервной системы формирует неадекватную реакцию структур ЦНС и способствует возникновению невропатической боли. На это указывают данные о существовании у крыс различных генетических линий высокой и низкой устойчивости к развитию невропатического болевого синдрома после перерезки седалищного нерва. Кроме того, анализ заболеваний, коморбидных невропатической боли, также свидетельствует о первоначальной несостоятельности регуляторных систем организма у этих пациентов. У пациентов с невропатической болью заболеваемость мигренью, фибромиалгией, тревожно-депрессивными расстройствами значительно выше по сравнению с пациентами без невропатической боли. В свою очередь у пациентов с мигренью коморбидными являются следующие заболевания: эпилепсия, синдром раздраженного кишечника, язвенная болезнь желудка, бронхиальная астма, аллергия, тревожные и депрессивные расстройства. Пациенты с фибромиалгией чаще болеют гипертонической болезнью, синдромом раздраженного кишечника, остеоартритами, тревожными и депрессивными расстройствами. Несмотря на разнообразие клинической симптоматики, перечисленные заболевания, могут быть отнесены к так называемым "болезням регуляции", сущность которых во многом определяется дисфункцией нейроиммуногуморальных систем организма, неспособных обеспечить адекватное приспособление к нагрузкам. Именно поэтому в определении невропатической боли наряду с указанием первопричины (повреждения соматосенсорной нервной системы) должен присутствовать либо термин "дисфункция", либо "дисрегуляция", отражающий важность нейропластических реакций, влияющих на устойчивость системы регуляции болевой чувствительности к действию повреждающих факторов. Нейропластические изменения затрагивают изменения эффективности синаптической передачи, структуры и функции несинаптических участков мембраны нейронов, сопровождающиеся стойким перепрограммированием экспрессии генов нейронов, приводящие к реорганизации взаимодействия между различными отделами мозга. Например, в условиях сенсорной деафферентации изменение рецептивных полей корковых нейронов происходит в первые 15 минут. В последнее время появились сообщения, свидетельствующие о том, что функциональная реорганизация нейронов наблюдается не только в структурах коры больших полушарий, но и в стволе мозга, и таламусе. Другим примером функциональной и структурной реорганизации мозга является кросс-модальная пластичность, наиболее ярко проявляющаяся в нейронах вторичных сенсорных и ассоциативных областей коры больших полушарий. В этом случае нейроны, реагирующие на одну сенсорную модальность, при лишении их обычного стимула становятся чувствительны к раздражителям других сенсорных модальностей. Кросс-модальная нейропластичность может стать причиной запуска болевых ощущений не только через специализированную ноцицептивную систему, но и другие сенсорные входы, преобразуя сетевую структуру нейронов и их перцептивную способность. Происходящие нейропластические изменения в структурах ЦНС далеко не всегда оказываются полезными, приспособительными, они могут быть также основой и для формирования патологических состояний (Г.Н. Крыжановский, 1997).
Такие "дефекты" в функционировании регуляторных систем организма могут быть "зашиты" в структуре генома человека. Современные данные по изучению связи между полиморфизмом генов и особенностями болевой чувствительности подтверждают высказанное предположение. В частности, показано, что функциональный полиморфизм в гене, кодирующем синтез фермента катехоламин-O-метилтрансферазы (КОMT), может влиять на метаболизм катехоламинов и в значительной мере изменять характер болевой чувствительности. Доказано, что гаплотипы с низкой чувствительностью к боли обеспечивают более высокий уровень ферментативной активности КОМТ по сравнению с гаплотипами, ассоциированными со средней и высокой болевой чувствительностью. Наличие даже одного гаплотипа, связанного с низкой болевой чувствительностью, в 2.5 раза уменьшает риск развития хронической боли, а наоборот, гаплотип, приводящий к 3-15-кратному снижению активности КОМТ, ассоциируется с развитием фибромиалгии и других хронических болевых синдромов. При этом ген, ответственный за синтез КОМТ, является одним из множества генов, так или иначе связанных с регуляцией болевой чувствительности. Следовательно, приведенные факты генетического полиморфизма в отношении КОМТ должны рассматриваться лишь в качестве примера, доказывающего связь между особенностями генотипа человека и его устойчивостью к действию различных агрессивных факторов среды, а не как генетическая основа боли.
Изучение особенностей биоэлектрической активности мозга у пациентов с невропатическими, хроническими и идиопатическими болевыми синдромами также свидетельствует о первичности изменений в фоновой ритмике ЭЭГ у данных пациентов, которые, обусловлены изначально существующей дисфункцией корково-подкорковых отношений, а не влиянием повреждения. Данные изменения ритмики ЭЭГ регистрируются в межприступный период при отсутствии боли, кроме того, у большинства пациентов с идиопатическими болевыми синдромами наблюдается снижение устойчивости ритмики мозга к функциональным нагрузкам -- гипервентиляции и фотостимуляции.
Таким образом, приведенные данные позволяют считать, что для возникновения невропатической боли необходимо драматическое соединение двух основных событий -- повреждения структур соматосенсорной нервной системы и дисфункции в корково-подкорковых отношениях головного мозга. Именно наличие дисфункции стволовых структур головного мозга порождает несбалансированную нейропластичность, которая и предопределяет реакцию мозга на повреждение, способствует существованию долго длящейся гипервозбудимости ноцицептивной системы и персистированию болевой симптоматики.
Психогенная боль. Боль является сложным субъективным феноменом, который определяется как "физическими" факторами, связанными собственно с болевой импульсацией, так и психологическим контекстом, который окружает болевую ситуацию (рис. 4).
Различные психические нарушения часто оказываются коморбидными для хронической боли. В целом логично их представлять как реакцию пациентов на сохраняющуюся боль и инвалидизацию. Однако, если проспективные исследования покажут, что фактором риска развития хронической боли, например достаточно распространееной боли в спине, являются отдельные психологические нарушения, это укрепит мнение о роли дисфункции ЦНС в формировании и поддержании хронической боли. Относительно недавно проведенные эпидемиологические исследования свидетельствуют в пользу того, что риск развития хронической боли повышен у людей с большим количеством стрессовых жизненных событий и психических нарушений в детстве и подростковым возрасте. Показана независимая от других факторов значимая связь между психологическими факторами - стрессом, тревожностью, депрессией, пассивными стратегиями преодоления боли, страхом, связанным с болью -- и возникновением боли в спине. Психологические факторы вносят больший вклад в развитие инвалидизации, связанной с болью в спине, чем биомеханические нарушения позвоночника и суставов конечностей. Психосоциальные факторы, связанные с трудовой деятельностью (неудовлетворенность работой, отсутствие ощущение контроля над выполняемой деятельностью, ощущения безопасности) влияют на частоту возникновения и длительность эпизодов боли в спине. Психосоциальные факторы риска в развитии хронической боли являются наиболее статистически значимыми и потенциально модифицируемыми.
Даже при одинаковой степени тканевого повреждения и интенсивности боли интерпретация значения боли, формирование связанной с ней инвалидизации будет определяться отношением к ней пациента, которое зависит в том числе и от условий, в которых возникает боль. Показана связь между выраженностью хронической боли, степенью инвалидизации и когнитивными составляющими боли.
Когнитивные составляющие боли. В оценке и восприятии боли, а также ее последствий большую роль играют представления и знания человека. Убеждения - основные и относительно неизменные представления о природе окружающего мира -- формируются у каждого человека с детства под влиянием воспитания, образования и воздействия других социальных факторов. Убеждения, связанные с болью, -- это представления конкретного человека о том, что такое боль и что она значит для него. C одной стороны, они являются очень личными, с другой -- обусловлены определенными культуральными влияниями. Например, когда скованность и боль в мышцах после занятий в тренажерном зале расцениваются человеком как «полезные», в то время как аналогичные ощущения, связанные с заболеванием, например фибромиалгией, имеют негативную оценку пациента.
Вклад ноцицепции в оба эти состояния может быть сходным, однако боль, связанная с заболеванием, играет роль эмоционального стрессогенного фактора. Другим примером может служить случай, когда ребенок, получивший ушиб лица о дверь, сопровождающийся носовым кровотечением, практически не испытывал никакой боли до тех пор, пока не увидел реакцию окружающих и не посмотрел в зеркало. Мысли о том, что произошло «что-то серьезное», могут вызывать достаточно интенсивную боль. Многие пациенты, страдающие хронической болью, в частности болью в спине, убеждены, что их боль является следствием значительного повреждения, несмотря на то, что тщательное обследование выявляет лишь минимальные нарушения. У них имеется представление о том, что выраженность боли соответствует степени поражения позвоночника, поэтому они, подчиняясь болевым ощущениям, максимально ограничивают физическую активность, увеличивая тем самым инвалидизацию. Выраженность страдания, связанного с болью, у этих пациентов очень высока. В то же время имеется небольшая группа больных, которых боль при значительных структурных нарушениях беспокоит намного меньше.
Большинство из них воспринимает ее как не опасную и не подчиняют ей свою активность. Уровень страдания у этих пациентов значительно меньше. Такие различия в восприятии болевых ощущений могут быть объяснены разными представлениями о природе заболевания и отношением к боли.
С негативными представления о значении боли и патологии позвоночника тесно связаны и отдельные аффективные характеристики боли - тревога и страх.
Боль для пациента играет роль стрессогенного фактора. Усилия, которые прикладывает индивидуум для разрешения или уменьшения стрессорного воздействия, называются стратегиями преодоления. К активным стратегиям преодоления боли относят применение специальных упражнений, сохранение двигательной активности, игнорирование боли.
Большинство стратегий преодоления боли формируется людьми путем «проб и ошибок» на основании собственных представлений и убеждений, советов друзей, родственников, врачей. Часто пациенты с хронической болью в спине предпочитают применять пассивные стратегии: подчиняют свое поведение болевым ощущениям, стараются меньше ходить и большую часть времени проводят в положении лежа, принимают большое количество анальгетиков и нередко нуждаются в посторонней помощи в своей повседневной активности.
Еще одной когнитивной составляющей боли, часто определяющей ее интенсивность и степень инвалидизации, является катастрофизация. Катастрофизация характеризуется крайне негативными представлениями пациента о собственном здоровье, когда даже незначительные отклонения самочувствия интерпретируются как заболевание с самым худшим прогнозом. Она приводит к выраженной психологической и физической дисфункции. Было показано, что уровень катастрофизации у пациентов с болью в спине не связан с выраженностью объективных неврологических и невроортопедических нарушений. Интенсивность боли, плохой эффект реабилитационных программ и большая частота обращения за медицинской помощью отмечались при более высоком уровне катастрофизации. Согласно D. Turk (1999), "основным, что отличает пациентов с высокой и низкой толерантностью к боли, является ее когнитивная обработка -- катастрофизация, которая предшествует, сопровождает и является следствием болевой стимуляции". Изменение представлений пациента о его боли является эффективным методом лечения различных хронических болевых синдромов и применяется в рамках когнитивно-поведенческой психотерапии.
Аффективные составляющие боли. Депрессия является наиболее частым психологическим расстройством при хронической боли, она отмечается в среднем у 30% пациентов, страдающих хронической болью (от10 до 100% случаев хронической боли, в зависимости от критериев для ее выявления). По данным отдельных авторов, при хронической боли в спине отсутствует линейная зависимость между болью и депрессией, отмечено лишь увеличение вероятности развития депрессии при увеличении числа болевых синдромов в других областях тела. Уменьшение выраженности боли приводит к регрессу депрессивных симптомов. G. Affleck с соавт. отметили, что депрессия связана с болью у пациентов с ревматоидным артритом, независимо от степени инвалидизации и активности процесса. Эти эпидемиологические данные свидетельствуют о связи боли и депрессии, однако не решают вопроса: боль приводит к депрессии или является ее следствием. Проспективные исследования с участием больных с хроническими скелетно-мышечными болями показали, что хроническая боль может вызвать депрессию, но и депрессия может приводить к хронической боли, а также возможно их взаимоусиливающее влияние.
Во многих культурах боль является более приемлемой причиной инвалидизации, чем депрессия, что дает существуют предпосылки для трансформации депрессии в боль. Тем не менее многие исследователи подчеркивают, что модель чисто психогенной боли столь же не состоятельна, как и модель "чисто органической" боли. Другим предполагаемым механизмом взаимоотношения боли в спине и депрессии может являться то, что и депрессия и тревога способствуют усилению, хронизации боли, повышая чувствительность к болевым стимулам, нарушая сон и ухудшая возможности пациента эффективно справляться с болезнью. Считается, что пережившие тяжелый эмоциональный стресс и депрессию пациенты склонны "обучаться" беспомощности и пассивному реагированию на различные стрессогенные факторы, включая боль, что приводит к дальнейшему усугублению эмоциональных нарушений. Поскольку боль и связанная с ней инвалидизация являются стрессорами, у ряда пациентов активируются негативные «схемы» и они неправильно (вплоть до логических ошибок) интерпретируют значение симптомов заболевания и страдают от возникающего в этом случае ощущения беспомощности и безнадежности. T. D. Maxwell и R. J. Gatchel, 1998, исследуя пациентов с хроническими болями в спине, показали, что с депрессией наиболее сильно связаны три когнитивных фактора: самоконтроль (мнение пациента о своей управлять жизнью и справляться с проблемами), наличие когнитивных ошибок (например, катастрофизация, избыточное обобщение) и ощущение препятствия участию в семейной, социальной и трудовой активности из-за боли в спине. При контроле указанных показателей у пациентов с хронической болью в спине не было выявлено достоверной связи боли и инвалидизации с депрессией.
В отличие от депрессии, преобладающей при хронической боли, тревога по поводу боли чаще отмечается в ее подострой (от 3 до 6 месяцев) стадии. В случае острой боли у пациента, как правило, имеется обоснованная надежда на регресс боли в ближайшем будущем. При подострой и хронизирующейся боли когнитивные и эмоциональные составляющие, связанные с болью, начинают изменяться. Пациент начинает беспокоиться о том, "прекратиться ли эта боль когда-нибудь?", предполагать, что "боль -- симптом серьезного заболевания", и что ему, возможно, "никогда не станет лучше". Эти и подобные мысли вызывают состояние тревоги, которая может различаться по выраженности -- от легкого беспокойства до сильного страха. Проявлениями тревоги могут являться:
- ощущение дрожи в теле, напряжение, тяжесть и боли в мышцах, беспокойство, утомляемость, невозможность расслабиться;
- вегетативные расстройства, включающие гипергидроз ладоней, учащенное сердцебиение, сухость рта, боль в эпигастрии, диарею, ощущение "кома" в горле, ощущение нехватки воздуха и т.п.;
- ощущение опасности, настороженность, "предчувствие беды";
- снижение концентрации внимания, раздражительность, нарушения сна.
Несмотря на убежденность большинства пациентов в том, что тревога "пройдет, когда исчезнет боль", тревожные расстройства часто усиливают восприятие боли и формируют "порочный круг", когда боль усиливает тревогу, а последняя в свою очередь повышает интенсивность боли.
Страх может являться значимым психологическим расстройством при хронической боли разной этиологии. Как правило, он связан с опасениями прогрессирования заболевания, нарастания интенсивности боли или обоими этими факторами. Часто страх неразрывно связан с тревогой; он может быть необоснованным, например при опасении пациента получить новую травму или повреждение, когда реальная угроза здоровью отсутствует. Если в таких случаях страх нарушает нормальную жизнедеятельность, он обозначается как "фобия". Фобия -- иррациональный страх какого-либо объекта, деятельности или ситуации. Например, к фобии относится необоснованный страх движения у пациента с хронической болью в спине. Такое состояние обозначается как "кинезиофобия". У пациентов, страдающих ею, отмечается скованность, замедленность, избыточная осторожность при движениях и другие двигательные ограничения. Как правило, кинезиофобия связана не столько с болью, сколько со страхом нанести себе повреждение и спровоцировать обострение болезни. Пациенты, страдающие кинезиофобией, часто не могут наклониться вперед, опасаясь "смещения позвонков" и "сдавления корешков", полностью избегают положения сидя и стараются постоянно "держать спину прямой", а также выполняют ритуальные действия при одевании, раздевании, перемене положения тела. Основной целью такого ограничительного поведения больных, является максимально возможное ограничение движений для предотвращения повреждения позвоночника. Такое поведение, если оно продолжается длительное время, ведет к гипотрофии мышц от бездействия. Поэтому попытки увеличить физическую активность в этом случае нередко приводят к нарастанию интенсивности боли из-за большей нагрузки на детренированные мышцы, что при отсутствии разъяснений со стороны врача может приводить к усилению страха перед физической активностью.В литературе указывается на высокую частоту симптомов соматизации (75-80% случаев) у пациентов с хроническими болями. Причина такой высокой частоты не известна; одни исследователи предполагают, что у отдельных пациентов соматические симптомы являются способом выражения психологического или социального дистресса, другие - что конституциональные или культуральные особенности усиливать и ошибочно интерпретировать телесные ощущения приводят к дистрессу и соматизации.
Болевое поведение. Формой вербальной (словесной) и невербальной коммуникации, необходимой для сообщения окружающим о том, что индивидуум испытывает боль, является болевое поведение. Действия, составляющие болевое поведение, не осознаны и обычно включают манеру речи, жалобы на боль, стоны, мимические, жестикуляционные, позные проявления, избыточный прием анальгетиков, обращение за медицинской помощью, прекращение работы. Термин "болевое поведение" впервые применил W. Fordyce в 1973 г., F.Keefe и A.Block, 1982 описали его проявления у пациентов с болями в спине. Болевое поведение при этом выражается в защитных жестах и позах, направленных на избегание боли (ограничение, замедленность, прерывистость и скованность движений, перенос массы тела на одну ногу), растирании, прикосновении, поддержке болезненной области, болевых гримасах (наморщивание лба, прищуривание, сжатие губ, опускание углов рта, стискивание зубов), шумном дыхании. При хронических болях часто отмечается так называемое неадаптивное болевое поведение, характеризующееся чрезмерной зависимостью от приема анальгетиков, малоподвижным образом жизни (в частности, проведение большей части времени в постели), ограничением социальных контактов. Реже встречается адаптивное болевое поведение, когда, несмотря на боль, пациенты стараются поддерживать повседневную активность дома, выполнять посильную нагрузку на рабочем месте, применяют упражнения, направленные на укрепление мышц. Болевое поведение зависит от всех факторов, рассматриваемых в модели формирования боли (тканевого повреждения, сенсорных характеристик боли, мыслей, эмоций, страдания). Оно также связано с жизненным опытом и культуральными особенностями, влияющими на способы выражения боли. Большим влиянием на болевое поведение также обладает внешнее окружение пациента. Положительное подкрепление (поощрение, поддержка) любой формы болевого поведения значимыми окружающими людьми увеличивает вероятность его повторения в будущем. Психологи приводят в качестве иллюстрации такую экспериментальную модель. Если преподаватель ведет занятия в аудитории, при этом студенты в тайне от него проинструктированы внимательно слушать преподавателя, когда он находится в левой ее половине, и наоборот, игнорировать его, когда он перемещается в правую, то через небольшой промежуток времени он будет вести занятия, находясь только в левой половине аудитории. Аналогично и у пациентов -- неадаптивное болевое поведение (жалобы на боль, выраженное ограничение повседневной активности) при наличии положительного подкрепления со стороны близких пациента (повышенное внимание и избыточно заботливое отношение) имеет больше шансов на повторение в будущем, тогда как игнорирование окружающими (супругом, врачом) такого поведения, напротив, уменьшает вероятность его повторения. Примерами положительного подкрепления болевого поведения могут быть предложения супруги "растереть мужу спину", когда тот громко стонет, или принести обезболивающее без его просьбы, "потому что на лице написано, что ему больно".
Прямое подкрепление болевого поведения значительно усиливает инвалидизацию и страдание, что в свою очередь приводит к усилению восприятия боли. Определенную роль в формировании болевого поведения играет и медицинская помощь. Пациенты с хронической болью, часто подвергаясь обследованию врачами, неосознанно учатся тому, что делать и говорить при осмотре, чего ожидать им, и что ожидают от них на приеме. Противоречивые советы и мнения, неудачные попытки лечения приводят к усугублению болевого поведения. У пациентов с выраженными признаками болевого поведения отмечается меньшая эффективность любого вида лечения.
Роль психологических факторов в формировании ощущения боли возрастает по мере трансформации острой боли в хроническую, при этом значение ноцицептивной импульсации, сопровождающей тканевое повреждение, становится менее значительным.
Таким образом, психические нарушения не только участвуют в подержании хронической боли и формировании связанной с ней инвалидизации, но преморбидные психические нарушения повышают риск развития хронической боли.
Согласно классификации Международной ассоциации по изучению боли, к психогенным болевым синдромам относятся:
- боли, провоцируемые эмоциональными факторами и обусловленные мышечным напряжением;
- боли как бред или галлюцинация у пациентов с психозами, исчезающие при лечении основного заболевания;
- боли при истерии и ипохондрии, не имеющие соматической основы;
- боли, связанные с депрессией, не предшествующие ей и не имеющие какой-либо другой причины.
В клинике психогенные болевые синдромы характеризуются наличием у пациентов боли, необъяснимой никакими известными соматическими заболеваниями или поражением структур нервной системы. Локализация этой боли обычно не соответствует анатомическим особенностям тканей или зонам иннервации, поражение которых можно было бы подозревать в качестве причины боли. Психогенные болевые синдромы, возникающие как бред или галлюцинация, могут проявиться у пациентов, страдающих шизофренией, для которых в общей структуре психопатологического синдрома характерны расстройства мышления и восприятия. Наряду со слуховыми и зрительными галлюцинациями у этих пациентов описаны галлюцинации кожного и мышечного чувства в виде ощущений болезненного давления в различных частях тела. Как правило, болевые проявления у таких пациентов имеют длительное течение. Эффективное лечение основного заболевания, устраняющего психопатологическую симптоматику, приводит к редукции и болевого синдрома. Возможны ситуации, при которых соматические повреждения, включая и нарушения структур соматосенсорной нервной системы, могут обнаруживаться, однако интенсивность боли при этом в значительной мере превышает степень повреждения. Иными словами, ведущим пусковым фактором в генезе психогенной боли является психологический конфликт, а не повреждение соматических или висцеральных органов или структур соматосенсорной нервной системы.
Вместе с тем, несмотря на то что причиной развития психогенных болевых синдромов считается психологический конфликт, появление болевого ощущения возможно только в случае активации ноцицептивной системы. Если при возникновении ноцицептивной или невропатической боли происходит прямая активация структур ноцицептивной системы (вследствие травмы тканей или повреждения ноцицептивных нейронов), то у больных с психогенной болью возможно ее опосредованное возбуждение: либо с помощью механизмов кросс-модальной нейропластичности активируются центральные ноцицептивные нейроны, либо по механизму ретроградной активации симпатическими эфферентами и/или посредством рефлекторного напряжения мышц происходит возбуждение ноцицепторов. Длительное напряжение мышц при психоэмоциональных нарушениях сопровождается усилением синтеза альгогенов в мышечной ткани и сенситизацией терминалей ноцицепторов, локализованных в мышцах. Психологический конфликт практически всегда также сопровождается активацией симпатической нервной системы и гипоталамо-гипофизарно-надпочечниковой оси, что может посредством α2-адренорецепторов, локализованных на мембране ноцицепторов, способствовать ретроградному возбуждению ноцицепторов и их последующей сенситизации с помощью механизмов нейрогенного воспаления. В данном случае из периферических терминалей ноцицепторов в ткани секретируются нейрокинины (субстанция Р, нейрокинин А и др.), которые обладают провоспалительным эффектом, вызывая увеличение проницаемости сосудов и высвобождение из тучных клеток и лейкоцитов простагландинов, цитокинов и биогенных аминов. Медиаторы воспаления, в свою очередь, воздействуя на мембрану ноцицепторов, повышают их возбудимость. Клиническим проявлением сенситизации ноцицепторов при психоэмоциональных расстройствах будут зоны гипералгезии, которые легко диагностируются, например, у пациентов с фибромиалгией или головными болями напряжения.
Поведенческая и когнитивно-поведенческая психотерапия. Учитывая роль психологических факторов и объективных нарушений в каждом отдельном случае хронического болевого синдрома, лечение пациентов должно включать коррекцию как источников боли, так и сопутствующих психологических расстройств. В психотерапевтической практике все чаще наблюдается интеграция когнитивного и поведенческого подходов, поскольку любые психотерапевтические воздействия в той или иной степени неизбежно затрагивают аффективную, мотивационную, когнитивную, поведенческую сферы, вызывая в них взаимосвязанные изменения.
Поведенческая психотерапия, основанная на принципе подкрепления, включает несколько аспектов: постепенную активизацию пациентов, уменьшение внешнего положительного подкрепления их болевого поведения, снижение зависимости от анальгетической терапии, обучение пациентов навыкам самоконтроля.
Постепенная активизация пациентов должна начинаться с разъяснения, что небольшая физическая активность не вредна, а полезна. Для этого целесообразно сначала попросить пациента вести дневник повседневной активности и затем вместе проанализировать, сколько времени в течение суток он проводит лежа из-за боли в спине. Например, если ежедневная нормальная активность пациента составляет лишь 4 часа, то начальной целью лечения может стать рекомендация проводить активно хотя бы по 20 минут из каждого часа. Постепенно продолжительность двигательной активности увеличивается, например до 5-10-минутного отдыха после 1.5 часов пребывания в вертикальном положении, а достижения фиксируются пациентом в дневнике. Активизацию целесообразно сочетать с занятиями лечебной физкультурой с постепенно нарастающими нагрузками, при этом предпочтительны аэробные упражнения (ходьба, плавание).
Положительное подкрепление со стороны супругов или других близких людей усиливает неадаптивное поведение. Поэтому необходимо изменить реакцию окружения пациента таким образом, чтобы вознаграждалось адаптивное болевое поведение и не поощрялось неадаптивное. При госпитализации нередко отмечается драматический регресс болевого поведения, т.к. устраняется его положительное подкрепление со стороны членов семьи. В свою очередь медицинский персонал должен быть обучен поощрять поведение больного, направленное на игнорирование боли.
Показано, что прием анальгетиков по мере увеличения интенсивности боли создает положительное подкрепление неадаптивному болевому поведению, т.к. при этом формируется порочный круг, при котором повышение дозы препарата приводит к усилению болевого поведения. Переход от приема анальгетика "по необходимости" на прием через строго определенные интервалы времени помогает эффективно разрушить этот порочный круг. Постепенно по мере уменьшения поведенческой зависимости от анальгетика удается значительно снизить его суточную дозу.
Важным является обучение пациентов навыкам самоконтроля с помощью самооценки выраженности боли и интенсивности физической активности, положительного самоподкрепления и релаксационных методик. При этом для самонаблюдения применяются дневники пациента. Многие больные отмечают, что сам факт такой регистрации позволяет им оценить положительный эффект от лечения.
В рамках когнитивно-поведенческой психотерапии используются многие описанные подходы поведенческой терапии. Когнитивно-поведенческая психотерапия является психосоциальным терапевтическим методом, с помощью которого происходит осознание пациентом особенностей текущего состояния; определение наиболее значимых целей по изменению самочувствия; формирование определенной психотерапевтической программы с помощью специалистов и ее успешная реализация. В связи с этим большинство современных когнитивно-поведенческих программ предусматривает уточнение особенностей психологического состояния пациента и помощь в их осознании; краткое обращение к истокам формирования психологических проблем пациента; предоставление ему информации о сущности болезни и способах ее преодоления; обучение новым способам мышления и поведения.
Важная роль отводится коррекции представлений пациента о природе возникновения болевых ощущений. Многие исследователи рекомендуют объяснять пациентам физиологические механизмы боли и роль эмоционального компонента в формировании болевых ощущений.
Тем не менее одной образовательной программы для уменьшения степени инвалидизации у пациентов с хронической болью недостаточно. Рациональная психотерапия позволяет скорректировать неправильные представления пациента о боли, уменьшить уровень связанных с ней страха и катастрофизации, однако ее оказывается недостаточно для повышения уровня повседневной активности. Так, для снижения степени инвалидизации у пациентов с болью в спине показано применение физической нагрузки, вызывающей типичные болевые ощущения, методом так называемой градуированной экспозиции. Этот вид поведенческой психотерапии направлен на то, чтобы пациент с поведением избегания, связанного со специфическими факторами (например, кинезиофобией), создал в своем воображении иерархию вызывающих страх и тревогу образов от менее до более пугающих, оставаясь на каждой "ступеньке" воздействия, пока страх и тревога не исчезнут. Эта процедура проводится под наблюдением врача с должным уровнем положительной поддержки. Когда пациент достигает понимания, что физическая активность не опасна, он увеличивает уровень повседневной активности, интенсивность боли в этом случае также снижается. В рамках когнитивно-поведенческой психотерапии больного обучают формулировке последовательных ближайших и отдаленных задач, связанных с избавлением от боли. Очень важно обсуждение вопроса о том, как изменится в жизнь пациента, если боль уменьшится и исчезнет. Нельзя просто удовлетвориться ответом, что "жить станет легче"; необходимо тщательно рассмотреть изменения всех сторон жизни и исходя из этого постепенно решать поставленные задачи: уменьшать зависимость от приема анальгетиков и необходимости в медицинской помощи, увеличивать бытовые и профессиональные нагрузки. После установления целей терапии пациента необходимо научить поведенческим навыкам, помогающим преодолевать боль или ее последствия: положительному подкреплению адаптивного поведения, релаксации, отвлечению внимания. Для последней методики очень важно объяснение доступным для пациента языком, желательно на знакомых ему примерах, как отвлечение внимания влияет на восприятие. Так необходимо подчеркнуть, что в каждый момент времени можно фокусировать внимание только на одном событии. Можно привести примеры с переключением телеканалов ("их всегда много, но реально мы можем смотреть только один") и объяснить, что при усилении боли важно ее игнорировать, а внимание необходимо сосредоточивать на приятных или индифферентных ощущениях, желательно вовлекающих несколько сенсорных модальностей (например, представить процесс разрезания яркого желтого ароматного лимона или вид, запахи и ощущение ветерка на высокогорном луге и т.п.). Более раннее применение психотерапии, особенно при ее сочетании с другими методами лечения, дает лучшие положительные результаты.
Таким образом, болевой синдром независимо от этиологии его возникновения является результатом активации ноцицептивной системы. При ноцицептивной и психогенной боли функционально-структурные изменения в системе болевой чувствительности проявляются сенситизацией периферических и центральных ноцицептивных нейронов, в результате которой повышается эффективность синаптической передачи и возникает стойкая гипервозбудимость ноцицептивных нейронов. У пациентов с невропатической болью структурные преобразования в ноцицептивной системе более значительны и включают формирование локусов эктопической активности в поврежденных нервах и выраженные изменения в интеграции ноцицептивных, температурных и тактильных сигналов в ЦНС, что проявляется в виде особого симптомокомплекса, характерного для невропатического болевого синдрома. Патологические процессы, наблюдаемые в ноцицептивных структурах периферической и центральной нервной системы, в динамике развития любого болевого синдрома тесно взаимосвязаны. Повреждение тканей или периферических нервов, усиливая поток ноцицептивных сигналов, приводят к развитию центральной сенситизации (долговременному повышению эффективности синаптической передачи и гиперактивности ноцицептивных нейронов спинного и головного мозга). Повышение активности центральных ноцицептивных структур, в свою очередь отражается на возбудимости ноцицепторов, например, посредством механизмов нейрогенного воспаления, вследствие чего формируется порочный круг, поддерживающий долго длящуюся гипервозбудимость ноцицептивной системы и способствующий хронизации боли.
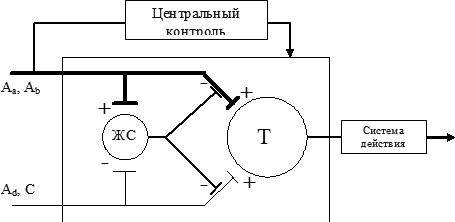
Рис. 1. Схема воротного контроля боли (R. Melzack, P. Wall, 1965).
Активация Аα-, Аβ-толстых миелинизированных низкопороговых афферентов неболевыми (тактильными и проприоцептивными стимулами) возбуждает нейроны желатинозной субстанции (ЖС), которые в свою очередь тормозят ноцицептивные нейроны спиноталамического тракта (Т) -- "ворота" закрыты). Активация Aδ, C-тонких высокопороговых ноцицептивных афферентов повреждающими стимулами тормозит нейроны желатинозной субстанции (ЖС), что обеспечивает свободное прохождение ноцицептивного импульса в структуры ЦНС ("ворота" открыты).
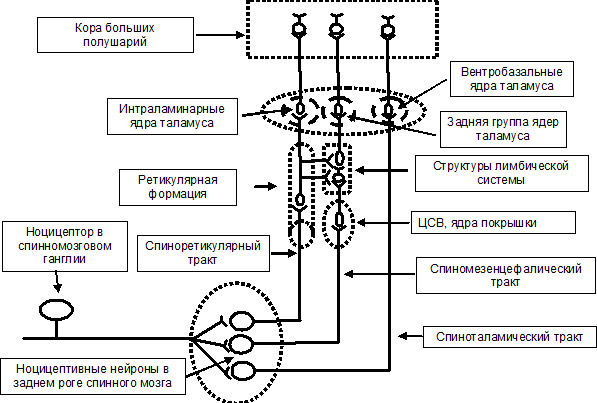
Рис. 2. Ноцицептивная система.
Ноцицептивная система представляет собой сложноорганизованную сеть нейронов, отвечающих на повреждающие стимулы и располагающихся в спинномозговых ганглиях и различных структурах ЦНС, начиная от задних рогов спинного мозга и заканчивая корой больших полушарий.
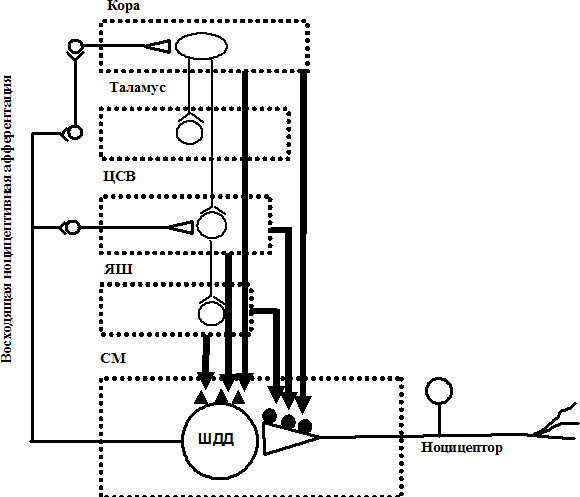
Рис. 3. Схема нисходящего антиноцицептивного контроля.
Восходящая ноцицептивная афферентация прямо или через корковые влияния обеспечивает активацию структур антиноцицептивной системы (центральное серое вещество -- ЦСВ, ядра шва -- ЯШ и др.), которые посредством нисходящего опиоидного, серонинергического и норадренергического пре- (черные кружки) и постсинаптического (черные треугольники) торможения снижают возбудимость нейронов широкого динамического диапазона (ШДД) в задних рогах спинного мозга (СМ).
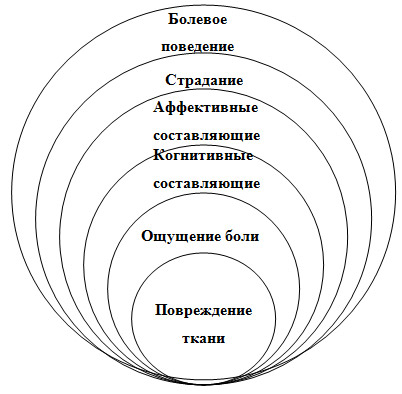
Рис. 4. Когнитивные и аффективные составляющие боли (по J. Loeser, D.Turk, 2001).