- Информация об обществе
- Общая информация
- Президиум РОИБ
- Комитеты РОИБ
- Региональные отделения РОИБ
- Секция молодых ученых
- Регистрация в РОИБ
- Конференции
- Российские конференции
- Международные конференции
- Архив российских конференций
- Регистрация на конференцию РОИБ
- Регистрация на вебинары
- Условия НМО
- Образовательные программы
- Клинические рекомендации
- Специалистам
- Справочные материалы и руководства
- Послеоперационная боль
- Организация противоболевой помощи
- Фундаментальные аспекты боли
- Мигрень
- Головные и лицевые боли
- Невропатические боли
- Боль в спине
- Висцеральная боль
- Болевые синдромы в онкологической практике
- Боль в гематологии
- Этика боли
- Ссылки на полезные источники информации
- Опросники и шкалы для оценки боли
- Профилактика боли
- Центры, клиники и кабинеты по лечению и изучению боли
- В помощь пациенту
- Контакты
Курс 9. БОЛЕВОЙ СИНДРОМ В ОНКОЛОГИИ
Терапия онкологической боли 3 / 4Современный арсенал средств и методов терапии боли позволяет воздействовать на все ее компоненты. Тем не менее, основные принципы терапии онкологической боли, рекомендованные Всемирной Организацией Здравоохранения в 1986 г., остаются неизменными и актуальными до сих пор, хотя периодически проводится обновление списка рекомендуемых препаратов фармакотерапии.
Основным постулатом этих рекомендаций является тезис: «Лекарственное лечение - основа борьбы с болью при раке». Подходы к лекарственной терапии раковой боли выражены в следующих пяти ключевых принципах:
1) «неинвазивность» то есть, преимущества отдаются препаратам с пероральным и трансдермальным способами введения, исключаются инъекционные формы анальгетиков;
2) «по часам», опережающее назначение анальгетиков, не дожидаясь развития сильной боли, позволяющее исключить «прорывы» боли и уменьшить побочные эффекты лекарственной терапии;
3) «по восходящей»- подбор препаратов для обезболивания осуществляется от неопиоидных аналгетиков к опиатам, по мере роста интенсивности боли («лестница ВОЗ» рис. 2.).
4) «индивидуальный подход» - предполагает необходимость «индивидуального» подбора анальгетика и основан на селективном выборе наиболее эффективного анальгетика в нужной дозе с наименьшими побочными эффектами для каждого конкретного пациента, с учетом особенностей его физического состояния;
5) «с вниманием к деталям» - предполагает учет особенностей и деталей каждого пациента, безусловно, назначение коанальгетиков и адъювантных средств, по мере возникновения необходимости в них, проведение мониторинга за больными.
Рисунок 2. «Лестница обезболивания ВОЗ».
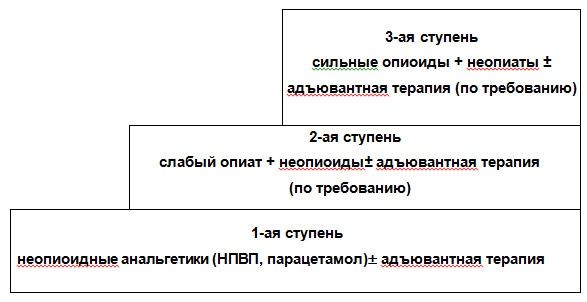
За прошедшие годы не раз проводились попытки пересмотра этой стратегии, предлагались 4-х, 5-ти ступенчатые схемы, и наоборот, некоторые исследователи доказывали, что лучшее качество жизни больных достигается при 2-х ступенчатой схеме, когда вместо малоэффективных «мягких опиоидов», сразу назначаются сильные препараты 3-й ступени в небольших дозах. Вероятно, все эти мнения заслуживают внимания и рассмотрения. 2-х ступенчатая схема без сомнения эффективна в руках специалиста, но в ежедневной практике врачей первичного звена: онкологов и терапевтов, семейных врачей, проводящих терапию боли у тяжелых онкологических пациентов в амбулаторных условиях, наиболее простой и безопасной остается 3-х ступенчатая схема ВОЗ. Именно она позволяет врачам, у которых нет специальных знаний анестезиолога, проводить обезболивание сильнодействующими препаратами на дому, постепенно повышая дозы и меняя анальгетики, по мере ослабления их эффективности.
Дополнительными компонентами анальгетической терапии являются и другие виды лечения, которые способны уменьшить боль, испытываемую пациентами:
- противоопухолевая терапия
- нефармакологическая терапия
- регионарная аналгезия
- инвазивные методы (нейроабляция и прочие)
Фармакотерапия является на сегодняшний день основным звеном в терапии боли ввиду своей эффективности, безопасности и относительно низкой стоимости. Считается, что при соблюдении вышеизложенных принципов ВОЗ фармакотерапия обеспечивает достаточный уровень обезболивания у 70-90% онкологических больных. Практический опыт и достижения фарминдустрии вносили коррекцию в перечень рекомендуемых для обезболивания препаратов. Если в 1986 году ВОЗ предлагала в качестве основных препаратов 1-й ступени – аспирин и парацетамол, на 2-й ступени – кодеин и декстропропоксифен, на 3-й ступени и морфин, петидин, бупренорфин и метадон, то уже спустя 10 лет во втором издании руководства ВОЗ «Облегчение раковой боли» (1996) на 1-й ступени базовыми препаратами наряду с аспирином и парацетамолом появились НПВП, имеющие меньшую токсичность при большей эффективности. К препаратам 2-й ступени добавились трамадол и дигидрокодеин, а к 3-й ступени добавились оксикодон, гидроморфон, леворфанол.
Многочисленные исследования последующих лет, выполненные после выхода в свет второго издания руководства ВОЗ по обезболиванию при раке, позволяют значительно расширить круг применяемых для обезболивания в онкологии лекарственных средств. В настоящее время терапия тяжелого болевого синдрома (третья ступень - по градации ВОЗ) может осуществляться с помощью целого арсенала препаратов с различными механизмами действия, различной степенью совместимости, различными показателями фармакокинетики и метаболизма. Ротация опиоидов, по данным зарубежных авторов, способна значительно снизить дозы препаратов и их побочные эффекты. В арсенале специалистов по терапии боли в экономически развитых странах находится большой арсенал опиоидных анальгетиков: кодеин, гидрокодон, трамадол, декстропропоксифен, морфин, оксикодон, бупренорфин, гидроморфон, метадон, фентанил и его производные и еще более десятка наименований. В нашей стране реально применяются только трамадол, тримеперидин (промедол), просидол, морфин, фентанил, (до недавнего времени был еще бупренорфин). Кодеин присутствует в микродозах (8мг) в комбинированных препаратах (на основе анальгина и парацетамола).Для его отдельного применения при терапии умеренной боли необходимы дозы от 30мг и выше.
Раньше базовым препаратом для обезболивания в онкологии был морфин (в таблетках или в растворе), который действовал не более 3-4 часов. В настоящее время созданы специальные формы пролонгированного действия (таблетки-ретард, капсулы с микрогранулами), высвобождающие лекарственное средство в течение 12 и даже 24 часов, с постоянной скоростью, не зависимо от приема пищи и уровня кислотности желудочного или кишечного содержимого. При этом исключаются пиковые токсические концентрации лекарственного препарата в крови, являющиеся причиной развития опасных побочных эффектов. Это повысило безопасность использования высоких доз опиоидов (морфина, дигидрокодеина, оксикодона, гидроморфона).
В конце ХХ столетия для терапии хронической боли были разработаны специальные пластыри, содержащие лекарственные вещества с системным действием и возможностью еще более продолжительного эффекта одной дозы аналгетика – до 3-х или до 7-ми суток.
Кроме разработки пролонгированных форм обезболивающих препаратов, другим востребованным направлением стало создание быстродействующих и, при этом, неинвазивных форм анальгетиков, для терапии «прорывов» боли. Для этой цели использовались трансмукозальный (подъязычный защечный), ректальный, интраназальный (спрей) и даже интратрахеальный пути введения целого ряда опиоидных анальгетиков: диаморфин, фентанил, алфентанил, суфентанил, бупренорфин, гидроморфон, оксикодон, метадон.
Третьим фактором, значительно повысившим эффективность и безопасность фармакотерапии боли, явилось создание различных комбинаций неопиоидных и опиоидных лекарственных средств (трамадол+парацетамол, кодеин+парацетамол, ибупрофен+кодеин, парацетамол+гидрокодон, парацетамол+оксикоодон), в результате чего в ряде случаев стало возможным блокировать достаточно интенсивную боль средствами из разных анальгетических групп 1-ой и 2-ой ступеней.
Одной из последних, наиболее интересных с научной точки зрения и востребованных в практическом плане стала разработка препарата на основе комбинации опиоидного анальгетика оксикодона и антагониста мю-опиоидных рецепторов – налоксона, соединенных в одной таблетке (препарат проходит регистрацию в нашей стране). Уникальность этой комбинации в том, что оба препарата (оксикодон и налоксон) высвобождаются из ретардной системы медленно, но оксикодон поступает через кишечник в системный кровоток, а налоксон практически не всасывается, но, взаимодействуя с мю-опиоидными рецепторами желудочно-кишечного тракта, ослабляет ЖКТ-ассоциированные побочные эффекты оксикодона.
Важнейшим достижением за последние десять лет в фармакотерапии боли вообще и в лечении онкологической боли в частности, является появление принципиально новых препаратов, специально предназначенных для терапии невропатической боли. Это антиконвульсанты последнего поколения - габапентин и прегабалин.
Ниже приводятся основные лекарственные препараты, зарегистрированные и применяемые в России на каждой ступени терапии боли с учетом их особенностей, имеющих значение для фармакотерапии у онкологических больных. Описаны предостережения, особенности фармакокинетики и элиминации, которые необходимо учитывать при лечении больных, получающих химио-лучевую терапию и ослабленных генерализованным опухолевым процессом, а также в терминальной стадии.
Фармакотерапия боли слабой интенсивности ( 1-ая ступень).
Особенностью данного этапа является непродолжительный болевой анамнез, интенсивность боли на уровне 1 балла по ШВО или около 10-30% по ВАШ. Характерна высокая эффективность неопиоидных аналгетиков, с продолжительностью действия препаратов более 4 часов. Основными препаратами являются парацетамол и НПВП. Метамизол натрия (анальгин) или комбинированные препараты на его основе применяются при противопоказаниях к НПВП или парацетамолу, либо при висцеральной боли со спастическим компонентом (рис.3).
Парацетамол и препараты на его основе назначаются в разовой дозе 0,5 -1,0 г , максимально 4,0 г в сутки. Длительность приема высшей дозы 4,0г не более 5-7 дней.
Предостережения: гепатотоксичен, нефротоксичен, особенно в сочетании с НПВС и метамизолом натрия (анальгином).
Особенности лекарственных взаимодействий:
- в высоких дозах повышает эффект антикоагулянтных лекарственных средств (ЛС).
- Совместное назначение с гепатотоксическими ЛС (фенитоин, этанол, барбитураты, рифампицин, трициклические антидепрессанты), повышает риск развития тяжелых интоксикаций даже при небольшой передозировке.
- Длительное совместное использование парацетамола и НПВП повышает риск развития "анальгетической" нефропатии и почечного папиллярного некроза, наступления терминальной стадии почечной недостаточности.
Элиминация: почками в виде метаболитов, преимущественно конъюгатов, только 3% в неизмененном виде.
Нестероидные противовоспалительные препараты.
Предостережения: эрозивно-язвенные поражения ЖКТ в стадии обострения, гипокоагуляция (в т.ч. гемофилия, геморрагический диатез, тромбоцитопения), бронхиальная астма, тяжелая хроническая сердечная недостаточность, гиповолемия, тяжёлая почечная и печеночная недостаточность, подтверждённая гиперкалиемия.
Предпочтение следует отдавать неселективным НПВП с коротким периодом полувыведения, высокую эффективность и наименьшие побочные эффекты:
- диклофенак, разовая доза 25-75 мг, суточная 150 мг.
- лорноксикам, разовая доза 4-8 мг, суточная 24 мг
- кетопрофен, разовая доза 50-100 мг, суточная 300 мг
В период лечения необходимо контролировать состояние ЖКТ с целью предупреждения ульцерогенного действия или желудочно-кишечного кровотечения. Снизить риск ульцерогенного действия позволяет одновременное назначение омепразола или блокаторов H2-гистаминовых рецепторов, синтетических аналогов Pg (мизопростол).
Элиминация:
- Диклофенак: выведение 60% введенной дозы в виде метаболитов через почки; менее 1% выводится в неизмененном виде, остальная часть дозы выводится в виде метаболитов с желчью. Одновременное назначение с селективными ингибиторами обратного захвата серотонина, этанолом, колхицином, кортикотропином и препаратами зверобоя повышает риск развития кровотечений в ЖКТ.
- Лорноксикам: полностью метаболизируется с образованием фармакологически неактивного метаболита, который выводится преимущественно с желчью (через ЖКТ) и только на 30% почками. Имеет наименьшую нефротоксичность, хороший профиль переносимости у пациентов старшей возрастной группы и у пациентов со сниженной функцией почек. Из всех НПВП имеет рН, наиболее приближенный к нейтральному, может вводиться внутривенно при прорывах боли.
- Кетопрофен: Практически полностью метаболизируется в печени путем глюкуронирования, имеет эффект "первого прохождения" через печень. Выводится преимущественно почками (нефротоксичен) и кишечником (1%). Не подвергается кумуляции.
НПВП, селективные ингибиторы ЦОГ -2.
Реже вызывают осложнения со стороны ЖКТ, но уступают в анальгетической эффективности неселективным НПВП.
Нимесулид
разовая доза 100 мг, суточная доза 200мг.
выводится почками (65%) и с желчью (35%), подвергается энтерогепатической рециркуляции.
Мелоксикам
разовая доза 7,5мг, суточная доза 15мг.
Метаболизм в печени - до неактивных метаболитов. Выводится через кишечник и почками (примерно в равной пропорции), в неизмененном виде - 5% суточной дозы (через кишечник).
Целекоксиб
разовая доза 100-200мг, суточная доза 200-400мг.
Выведение с калом и мочой (57 и 27% соответственно), менее 3% принятой дозы - в неизмененном виде.
Эторикоксиб
разовая доза 60-90мг, суточная доза 60-90-120мг.
Выведение с 70% препарата выводится через почки, 20%- через кишечник, преимущественно в виде метаболитов.
Метамизол натрия (анальгин) и комбинированные препараты на его основе.
Анальгин для системной терапии назначают только в случаях невозможности применения парацетамола или НПВП. Анальгезирующее действие сочетается жаропонижающим и спазмолитическим действием (в отношении гладкой мускулатуры кишечника, мочевыводящих и желчных путей).
Анальгин: разовая доза 250-1000мг, суточная доза 2000мг.
Предостережения: нефротоксичен особенно в сочетании с НПВП или парацетамолом (олигурия, анурия, протеинурия, интерстициальный нефрит), гематотоксичен (агранулоцитоз, лейкопения, тромбоцитопения).
Особенности взаимодействия :
- увеличивает активность пероральных гипогликемических ЛС, непрямых антикоагулянтов, глюкокортикостероидов, индометацина.
- одновременное назначение с другими ненаркотическими анальгетиками, трициклическими антидепрессантами, аллопуринолом может привести к усилению их токсичности.
- тиамазол и цитостатики повышают риск развития лейкопении.
- эффект усиливают кодеин, блокаторы H2-гистаминовых рецепторов и пропранолол (замедляет инактивацию). Усиливает эффекты этанола.
- миелотоксические ЛС усиливают проявления гематотоксичности препарата.
Элиминация: гидролизуется в стенке кишечника с образованием активного метаболита, который связывается с белками - 50-60%, метаболизируется в печени, выводится почками.
Фармакотерапия боли умеренной интенсивности ( 2-я ступень).
У больных с умеренной интенсивностью боли оценка по ШВО составляет 2 балла, оценка по ВАШ до 50%. Продолжительность предшествующего ХБС, как правило, около 2-3 мес. , но встречается и болевые состояния возникающие менее 1-2 недели.
При неэффективности препаратов, предназначенных для терапии слабой боли следует назначать ЛС, относящиеся к группе слабых (мягких) опиоидных анальгетиков среди которых препаратом первой линии является трамадол, а при усилении боли просидол или начальная доза ТТС бупренорфина 35мкг/ч. (рис.4).
Трамадол.
Минимальная доза трамадола содержится в комбинированном препарате трамадол 37,5мг+ парацетамол 325мг –Залдиар(6), который следует назначать по 1-2 таблетки 2-4 раза в день. Эффективность 2-х таблеток залдиара сопоставима со 100 мг трамадола, при меньших побочных эффектах. Максимальная суточная доза этого препарата составляет 8 таб.
Трамадол применяется в разовой дозе от 50 мг (в 1 капсуле) до 100 и 200 мг в таблетке ретард. Таблетки ретард наиболее предпочтительны в длительной терапии онкологической боли. Максимальная суточная доза 400мг.
Предостережения. Трамадол – препарат сложного анальгетического действия:
- является слабым агонистом опиоидных мю-рецепторов, что обуславливает сухость во рту, тошноту, рвоту, метеоризм, боль в животе, повышенное потоотделение, головокружение, головную боль, слабость, повышенную утомляемость, заторможенность и др.;
- блокирует обратный захвата норадреналина и серотонина в нейрональных синапсах, в результате чего возможны эффекты парадоксальной стимуляции ЦНС: нервозность, ажитация, тревожность, тремор, спазмы мышц, эйфория, эмоциональная лабильность, галлюцинации, нарушения координации движений и др.
Лекарственные взаимодействия:
- несовместим в одном шприце с растворами диклофенака, индометацина, фенилбутазона, диазепама, флунитразепама, нитроглицерина
- не рекомендуется одновременно с большими дозами трициклических антидепрессантов
- усиливает действие препаратов, угнетающих ЦНС, и этанола.
- индукторы микросомального окисления (в т.ч. карбамазепин, барбитураты) уменьшают выраженность анальгезирующего эффекта и длительность действия.
Элиминация: Метаболизируется в печени с образованием активных метаболитов, выводится почками – 94% (25-35% в неизмененном виде).
Просидол (пропионилфенилэтоксиэтилпиперидин).
Особенности: имеет выраженное спазмолитическое, сосудорасширяющее и умеренное противокашлевое действие.
Применяется в защечных таблетках по 10 и 20 мг. Разовая доза 10-40 мг. Максимальная суточная доза- 240мг. Эффект обезболивания начинается через 15-20 мин.
Предостережения: (свойственны всем наркотическим анальгетикам)
- нервная система: головокружение, слабость, головная боль; судороги,
- пищеварительная система: сухость во рту, тошнота, рвота, нарушение функции печени, атония кишечника;
- сердечно-сосудистая система: снижение АД, брадикардия.
- мочевыделительной системы: атония мочевого пузыря
- прочие: привыкание, синдром "отмены", при передозировке - нарушение дыхания.
Лекарственные взаимодействия:
- усиливает действие гипотензивных лекарственных средств;
- транквилизаторы, снотворные, этанол, антипсихотические ЛС усиливают действие просидола;
- налоксон и налтрексон являются специфическими антагонистами.
Элиминация:
Метаболизируется в печени с образованием неактивных глюкуронизированных метаболитов. Выводится в основном почками, как в виде метаболитов, так и в активной форме.
Промедол (тримеперидин).
Препарат не предназначен для длительной терапии боли.
В виду, того, что промедол широко применялся раньше у онкологических больных и до сих пор используется во многих регионах нашей страны, где нет других современных неинвазивных форм опиоидных анальгетиков, необходимо помнить ряд важных особенностей этого препарата. Промедол подвергается биотрансформации с образованием нейротоксичного Н-деметилированного метаболита – нормеперидина, который стимулирует ЦНС (возможны тремор, подергивания мышц, гиперрефлексия, судороги). Метаболит имеет длительный период полужизни (15—20 ч), поэтому может наблюдаться кумулятивный эффект, что особенно часто возникает у онкологических больных. В связи с этим рекомендуется сократить время терапии до 3-5 дней.
Обезболивающий эффект промедола по отношению к морфину меньше в 2-4 раза, при этом системное воздействие промедола на ЦНС подобно истинным опиатам, но с более выраженными атропиноподобными свойствами. Промедол, в противоположность морфину и другим опиоидам, не замедляет ритм сердца, напротив, благодаря своему структурному сходству с атропином, он способен увеличивать частоту сердечных сокращений. При энтеральном применении эффективность промедола снижается в 2-3 раза (поэтому таблетки промедола не нашли широкого применения, их эффект сопоставим с таковым с трамадолом). Промедол меньше, чем морфин угнетает дыхательный центр, меньше возбуждает центр блуждающего нерва и рвотный центр. Оказывает умеренное спазмолитическое действие на гладкую мускулатуру внутренних органов и, вместе с тем, повышает тонус и усиливает сокращения мускулатуры матки. Ввиду кратковременности эффекта введенной внутримышечно дозы промедола (в среднем 4ч.), основным показанием к его применению является, прежде всего, острая боль (сильной и средней интенсивности): послеоперационная боль, травмы, ожоги, болевые синдромы в клинике внутренних болезней (нестабильная стенокардия, инфаркт миокарда и др.).
Фармакотерапия сильной боли (3-я ступень).
При сильных болевых синдромах интенсивность боли составляет более 3 баллов по ШВО и более 50-70% по ВАШ, эффективность трамадола или его комбинации с НПВП недостаточна; продолжительность болевого синдрома, как правило, более 3 месяцев. В случаях неэффективного обезболивания «мягкими» опиоидами в сочетании с адъювантными средствами назначаются сильнодействующие опиоидные анальгетики (морфин, фентанил, бупренорфин) или высокие дозы просидола (непродолжительно), как переходного анальгетика (рис.5).
Трансдермальная терапевтическая система (ТТС) бупренорфина ( Транстек).
Форма выпуска и дозы ТТС Транстек: пластыри с содержанием бупренорфина 35, 52,5 и 70 мкг/ч. Начальная доза 35 мкг/ч эквивалентна 150-300 мг/сут. трамадола, принятого внутрь. Максимальная доза - 140 мкг/ч. Начало обезболивающего действия ТТС наступает через 18-24 часа после аппликации. Длительность действия ТТС 72 часа и более (до 4-х суток). Низкие дозы ТТС бупренорфина – Транстек (35 и 52,5 мкг/ч) применяются для терапии умеренной боли.
Особенности: Бупренорфин реже вызывает привыкание и лекарственную зависимость, чем истинные опиатные анальгетики. Поскольку максимум эффекта ТТС наступает через 18-24 часов, в течение первых суток необходимо сохранять и постепенно снижать прежнюю обезболивающую терапию.
Предостережения: те же, что у всех опиоидных анальгетиков:
- нервная система: головокружение, слабость, головная боль, судороги;
- пищеварительная система: сухость во рту, тошнота, рвота, нарушение функции печени, атония кишечника;
- сердечно-сосудистая система: снижение АД, брадикардия;
- мочевыделительной системы: атония мочевого пузыря.
Не следует назначать у пациентов с выраженным нарушением кишечного пассажа (динамическая кишечная непроходимость, сильные запоры и проч.).
Лекарственные взаимодействия: не совместим с фентанилом и морфином (ослабляет их действие). Препаратом дотации является трамадол в небольших дозах (до 200 мг/сут), неопиоидные анальгетики.
Элиминация: Метаболизируется в печени до активных метаболитов, выводится преимущественно с желчью (70%), через ЖКТ, 30 % почками.
Морфин сульфат, таблетки ретард ( МСТ – континус).
Форма выпуска, дозы: таблетки замедленного высвобождения (12 часов) по 10, 30, 60, 100 мг.
Разовая доза 20-100 мг (и более), суточная – до 400 мг и более. Низкие дозы - 2 таблетки по 10 мг дважды в сутки применяют у пациентов с весом менее 50 кг. При непереносимости трамала возможно применение 10-20 мг МСТ в сутки для терапии умеренной боли.
Особенности: возможны гистаминоподобные реакции (крапивница, кожный зуд, бронхоспазм), обладает умеренным противокашлевым действием. Необходимо учитывать, что только 25-30% принятого энтерально морфина попадает в системный кровоток, оставшаяся часть выводится с калом.
Предостережения: те же, что у всех опиоидных анальгетиков (см. выше). Из-за особенностей элиминации следует снижать дозу у пациентов с нарушением кишечного пассажа, почечной и печеночной недостаточностью. Таблетки МСТ нельзя делить, при этом вся доза препарата быстро поступает в системный кровоток, возможна передозировка.
Лекарственные взаимодействия: те же, что у просидола. Совместим с фентанилом и просидолом, промедолом, трамадолом.
Элиминация: Метаболизируется в печени до активных метаболитов, выводится преимущественно с почками -85%, с желчью -10%.
Трансдермальная терапевтическая система фентанила (Дюрогезик) :
Форма выпуска, дозы: 12,5; 25; 50, 75 и 100 мкг/ч, действие ТТС длится 72 часа.
Особенности: Самый сильный опиоидный анальгетик, среди препаратов, предназначенных для терапии хронической боли. После аппликации ТТС максимум эффекта наступает через 18-24 часа, из-за чего в течение первых суток необходимо сохранять прежнюю обезболивающую терапию. Доза 12,5 мкг/ч предназначена для терапии умеренной боли или неонкологической боли.
Предостережения: те же, что у всех опиоидных анальгетиков (см. выше). Начинать терапию следует с дозы 25мкг/ч или с соответствующей эквианальгетической дозы, подобранной по специальной таблице ( в инструкции к препарату). С осторожностью назначается при брадиаритмии, артериальной гипотензии, почечной, печеночной недостаточности. Возможно развитие ригидности мышц (в том числе грудных) и затруднение дыхания.
Лекарственные взаимодействия: те же, что у просидола и морфина. Бупренорфин, налбуфин, пентазоцин, налоксон, налтрексон снижают анальгезирующий эффект фентанила и устраняют угнетающее его влияние на дыхательный цент
Общие предостережения.
Недостатками длительного лечения опиоидами являются: опиоидная резистентность и побочные эффекты. Побочные эффекты (седация, тошнота, рвота, запоры, задержка мочи и др.) обычно представляют меньше забот, многие из них уменьшаются со временем от начала терапии, либо купируются назначением адъювантов. Возникающая же со временем устойчивость к введению опиоидов является большой и трудноразрешимой проблемой. Необходимость в увеличении доз наркотических аналгетиков обычно наблюдается через 2-3 недели от начала лечения и их дозы могут увеличиваться в десятки раз по сравнении со стартовыми.
В последнее время в литературе появилось понятие опиоид-вызванная гипералгезия, патогенез которой не до конца ясен. Данный феномен чаще всего наблюдается уже на поздних стадиях онкологического заболевания при применении высоких доз опиоидов и проявляется либо усилением болей, несмотря на повышающиеся дозы опиоидов, либо аллодинией. Предполагают, что подобное явление возникает вследствие активации NMDA-рецепторов в ЦНС и нарушения баланса активности возбуждающих и тормозных нейронов.
При развитии опиоидной резистентности рутинной практикой является смена наркотического аналгетика (ротация опиоида). Эффективность подобной тактики у определенного процента больных показана многими авторами, хотя четкого научного обоснования факта, почему некоторые пациенты резистентны к морфину, но отвечают на другие опиоиды, на сегодняшний день пока не существует. Вероятно, это обусловлено генетическими факторами, определяющими индивидуальную восприимчивость и реакцию на опиоид.