- Информация об обществе
- Общая информация
- Президиум РОИБ
- Комитеты РОИБ
- Региональные отделения РОИБ
- Секция молодых ученых
- Регистрация в РОИБ
- Конференции
- Российские конференции
- Международные конференции
- Архив российских конференций
- Регистрация на конференцию РОИБ
- Регистрация на вебинары
- Условия НМО
- Образовательные программы
- Клинические рекомендации
- Специалистам
- Справочные материалы и руководства
- Послеоперационная боль
- Организация противоболевой помощи
- Фундаментальные аспекты боли
- Мигрень
- Головные и лицевые боли
- Невропатические боли
- Боль в спине
- Висцеральная боль
- Болевые синдромы в онкологической практике
- Боль в гематологии
- Этика боли
- Ссылки на полезные источники информации
- Опросники и шкалы для оценки боли
- Профилактика боли
- Центры, клиники и кабинеты по лечению и изучению боли
- В помощь пациенту
- Контакты
Курс 9. БОЛЕВОЙ СИНДРОМ В ОНКОЛОГИИ
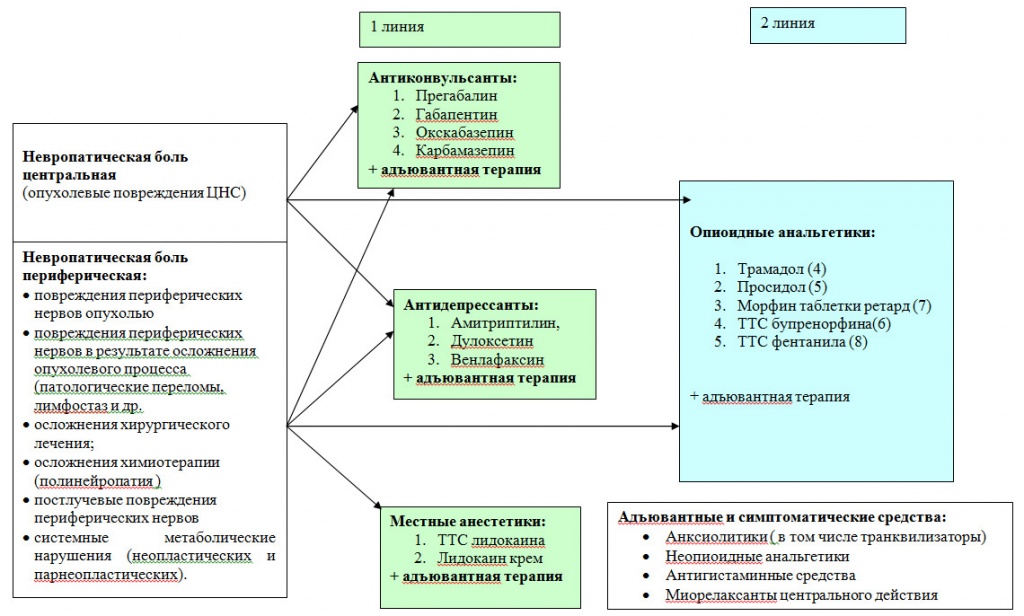
Терапия невропатического синдрома в онкологии 4 / 4Для терапии невропатической боли в онкологии еще недавно традиционными препаратами были трициклические антидепрессанты (ТЦА), среди которых основным и самым распространенным является амитриптилин. Терапевтические дозы амитриптилина при терапии невропатических болей составляют 75-150 мг, что практически невозможно применять у онкологических больных из-за его специфических побочных свойств и лекарственных взаимодействий. Побочные эффекты амитриптилина, обусловленные блокадой м-холинорецепторов (сухость во рту, задержка мочеиспускания и кишечной перистальтики, усиленное потоотделение) подобны тем, что возникают при раковой интоксикации и лечении опиоидами. При приеме препарата они усугубляются, значительно ухудшая качество жизни больных. Кроме того, амитриптилин кардиотоксичен, противопоказан при глаукоме, гиперплазии предстательной железы, пилоростенозе и др. Применение амитриптилина возможно только в ограниченном диапазоне доз от 10 до 50мг в сутки, что бывает недостаточно для терапии боли.
Применение препаратов из группы антиконвульсантов является наиболее патогенетически обоснованным. Длительное время препаратом первой линии для терапии невропатической боли был карбамазепин. Его побочные эффекты (высокий риск развития лейкопении и тромбоцитопении, кардио- и гепатотоксичность, интерстициальный нефрит, и пр.) ограничивают его применение при проведении противоопухолевой терапии.
В настоящее время среди антиконвульсантов наиболее эффективными препаратами для лечения невропатической боли являются габапентин (нейронтин, тебантин) и прегабалин (лирика), которые приводятся в качестве препаратов первой линии для терапии невропатической боли в Европейских рекомендациях по терапии невропатической боли, а также рекомендованы к использованию Европейским онкологическим сообществом. Они имеют неоспоримые преимущества в сравнении с антиконвульсантами предыдущего поколения по эффективности при меньших побочных эффектах. Эффективность прегабалина и габапентина подтверждена международными рандомизированными исследованиями, в том числе при лечении невропатической боли у онкологических пациентов, принимающих опиаты. Прегабалин с успехом применяется у онкологических больных при периферической невропатии, индуцированной химиотерапией. В проведенном исследовании у пациентов при невропатической боли, вызванной химиотерапией, наибольшую эффективность, по сравнению, с опиоидами, нестероидными противовоспалительными средствами, карбамазепинами, показал прегабалин (N.Attal, 2008).
В настоящее время также проводится плацебо-контролируемое исследование (IV фаза) эффективности и переносимости прегабалина в лечении боли в костях, вызванной раком (A Randomized Placebo-Controlled Trial of the Efficacy and Tolerability of Flexibly Dosed Pregabalin in the Treatment of Cancer-Induced Bone Pain (Pfizer) Clinical Research at VIC Oct 2007), результаты которого вероятно скоро станут известны. На онкологическом конгрессе в 2010 г. М. Garassino были представлены результаты II фазы сравнительного исследования сочетанного применения прегабалина и оксикодона в двух группах больных. В одной группе пациенты получали фиксированную дозу прегабалина 50 мг в сочетании с постепенно повышающейся дозой оксикодона, в другой, напротив, к постоянной дозе оксикодона 10мг дополнительно назначался в нарастающей дозе прегабалин. В обеих группах отмечено снижение интенсивности боли по ШВО на одну треть от исходной у 71.4% и 78.9% больных обеих групп. Исследование будет продолжено.
Исследования эффективности и переносимости прегабалина проведенные в МНИОИ им. П.А.Герцена также показали высокую эффективность прегабалина в терапии невропатического компонента боли у онкологических больных. Значимый анальгетический эффект прегабалина выявлен, начиная с 3-х суток терапии при достижении средней суточной дозы препарата 170,76±52,51 мг. При увеличении дозы прегабалина до 285,85±105,11 мг/сут на 7-е сутки интенсивность боли снизилась на 46% по ВАШ (с 67% до 21%); что даже позволило значительно сократить дозы исходно принимаемых анальгетиков: у 53% больных снизить дозы НПВП на 20-50%, отменить полностью НПВП у 11%, снизить дозы опиоидов: трамадола у 12% больных, морфина - у 45%, ТТС фентанила - у 22%. Особенно значимым является синергетический эффект прегабалина и трамадола. В нашем исследовании прегабалин потенцировал действие трамадола в 70% случаев, что позволило эффективно контролировать сильную боль (3-й ступени), при которой терапия трамадолом была уже исчерпана и пациентам был показан переход на сильнодействующие опиоиды (морфин, фентанил). Длительность устойчивого обезболивания сильно варьировала, от 1 недели до 6 месяцев и зависела от скорости опухолевой инвазии и эффективности противоопухолевой терапии. Учитывая хорошую переносимость средних терапевтических доз прегабалина (сильно выраженные побочные эффекты были причиной отмены прегабалина только у 6,7% больных), его способность нормализовать ночной сон и расширять физическую активность у больных, не получающих сильнодействующие опиоиды можно признать, что прегабалин обладает хорошим балансом эффективности и безопасности.
Применение опиоидных анальгетиков в терапии невропатических болевых синдромов широко дискутируется. С одной стороны нет убедительных доказательств их бесполезности, но и их эффективность гораздо ниже, чем при терапии ноцицептивной боли. С другой стороны, выраженные побочные эффекты при длительном приеме опиоидных препаратов, такие как головокружение, седативный эффект, когнитивная дисфункция, зуд, повышенное потоотделение, запор, эндокринные дисфункции (феминизация мужчин, аменорея и бесплодие у женщин, гипотиреоз) вызывают опасения у врачей. Кроме этой стороны, получение больными лекарственных препаратов содержащих опиоиды настолько сложно в нашей стране, что врачи до последней возможности вынуждены применять сложные схемы сочетанной неопиоидной фармакотерапии, в том числе и у онкологических пациентов. Таким образом, в силу ряда причин, опиоиды остаются препаратами 2-й при терапии невропатических болевых синдромов.
В терапии невропатической боли у онкологических больных остаются актуальными все препараты, применяемые с этой целью в неврологической клинике. К ним относятся окскарбазепин (трилептал), который обладает доказанной эффективностью в терапии болевых синдромов орофарингеальной зоны и имеет лучший профиль безопасности, чем карбамазепин.
Отдельно необходимо остановиться на применении местных анестетиков, а именно лидокаина. Известны работы, где лидокаин с успехом применяли внутривенно для терапии боли, вызванной постгерпетической невралгией. Такая терапия достаточно рискованна из-за системного действия лидокаина на сердечно-сосудистую систему; ее проведение возможно только в условиях стационара у «сохранных» пациентов, не имеющих сопутствующей кардиальной патологии, без дефицита водного баланса, с сохранной функцией печени. Этих недостатков лишена ТТС лидокаина, в которой анестетик постепенно высвобождающийся из пластины, создает клинически значимую концентрацию только в поверхностных слоях кожи, где находятся рецепторы, воспринимающие боль, не оказывая системного воздействия на организм больного. Точкой приложения пластыря с лидокаином (Версатис) являются состояния, сопровождающиеся отчетливо сформированными локальными зонами гипералгезии и/или аллодинии.
Применение современных антидепрессантов - ингибиторов обратного захвата серотонина и норадреналина венлафаксина и дулоксетина в терапии онкологического болевого синдрома изучено недостаточно. Требуется больший опыт для того, чтобы сделать значимые выводы. Побочные эффекты СИОЗСиН (тошнота, рвота, сонливость), ограничения использования при исходно пониженной массе тела, почечная/печеночная недостаточность, ограничивают их широкое применение в онкологии.
Применение антагонистов NMDA рецепторов кетамина ограничено в нашей стране из-за его принадлежности к списку наркотических средств и психотропных веществ, оборот которых в РФ ограничен, и в отношении которых устанавливаются меры контроля в соответствии с законодательством РФ (список II). Кетамин используется только в анестезиологии.
При болевых состояниях связанных с повышением мышечного тонуса могут использоваться a2–адренергический миорелаксант тизанидин (сирдалуд) или противосудорожный препарат антагонист NMDA рецепторов - ламотриджин (ламиктал). Эти специфические препараты должны применяться с учетом их переносимости и лекарственных взаимодействий.
Фармакотерапия невропатической боли у онкологических больных (рис.6).
Габапентин (тебантин, нейронтин)
Разовая доза 150-300 мг, суточная 900-1800мг (до 3600мг)
Особенности: имеет низкую токсичность.
Предостережения: возможны (в первые дни приема) головокружение, диарея, двоение в глазах, нарушение речи, сонливость.
Лекарственные взаимодействия: Антациды (содержащие Al3+ и Mg2+) снижают биодоступность на 20%
Элиминация: не подвергается метаболизму в печени, выводится в неизменном виде почками.
Прегабалин (лирика)
Разовая доза 75-300 мг, суточная 150-600 мг
Особенности: имеет низкую токсичность, лучший профиль переносимости, чем габапентин.
Предостережения: с осторожностью назначается при почечной недостаточности.
Лекарственные взаимодействия: Прегабалин может усиливать эффекты этанола и лоразепама.
Элиминация: не подвергается метаболизму в печени, выводится в неизменном виде почками до 98%.
Окскарбазепин (трилептал)
Разовая доза 300 мг, суточная 900-1800мг (до 3600мг)
Особенности: высокоэффективен в терапии невропатической боли орофациальной зоны, имеет меньшую токсичность в сравнении с карбамазепином.
Предостережения: возможны сонливость, головная боль, головокружение, диплопия, тошнота, рвота, чувство усталости, с осторожностью назначается при почечной и печеночной недостаточности..
Лекарственные взаимодействия: окскарбазепин и его метаболиты являются индукторами цитохромов CYP3A4 и CYP3A5, ингибиторами цитохрома CYP2C19, что имеет следствием большое количество лекарственных взаимодействий.
Элиминация: подвергается метаболизму в печени с образованием активных метаболитов, которые выводится почками 95%.
Карбамазепин (финлепсин)
Разовая доза 200 мг, суточная 400-600 мг (до 1600мг)
Особенности: при длительном приеме возможны лейкопения и агранулоцитоз, имеет самую высокую гепато- и нефротоксичность из всех вышеперечисленных антиконвульсантов. С осторожностью назначается у пациентов пожилого возраста.
Предостережения: хроническая сердечная недостаточность, гипонатриемия разведения (гипопитуитаризм, гипотиреоз, недостаточность коры надпочечников), угнетение костномозгового кроветворения; печеночная недостаточность, почечная недостаточность; гиперплазия предстательной железы, повышение внутриглазного давления.
Лекарственные взаимодействия: ускоряет метаболизм непрямых антикоагулянтов, фолиевой кислоты; может усиливать элиминацию гормонов щитовидной железы.
Элиминация: подвергается метаболизму в печени с образованием активных метаболитов, которые выводится почками 95%.
Амитриптилин
Разовая доза 10-25 мг, суточная 10-50 мг (до 200мг)
Особенности: Высокоэффективен, но при длительном приеме возможны лейкопения и агранулоцитоз, имеет самую высокую гепато- и нефротоксичность из всех вышеперечисленных антидепрессанов.
Предостережения: кардиотоксичен, гепатотоксичен, нефрототоксичен, противопоказан при глаукоме, аденоме предстательной железы и др. Не следует повышать дозу более 25-50 мг в сут., не следует назначать одновременно с трамадолом.
Лекарственные взаимодействия: При совместном применении этанола и ЛС, угнетающих ЦНС (в т.ч. др. антидепрессантов, барбитуратов, бензадиазепинов и общих анестетиков), возможно значительное усиление угнетающего действия на ЦНС, угнетение дыхания и гипотензивный эффект. При совместном назначении с др. гематотоксичными ЛС возможно усиление гематотоксичности.
Элиминация: подвергается метаболизму в печени с образованием активных метаболитов, которые выводится почками 80%.
Венлафаксин (велафакс)
Разовая доза 37.5 мг, суточная 70-225мг.
Особенности: с осторожностью назначается пациентам с кардиальной патологией, стенокардией, глаукомой, почечной недостаточностью.
Предостережения: головокружение, астения, слабость, бессонница, повышенная нервная возбудимость, повышение АД, гиперемия кожи.
Элиминация: подвергается метаболизму в печени с образованием активных метаболитов, которые выводится почками 87%.
Дулоксетин (симбалта)
Разовая доза 30-60 мг , суточная 60-120мг.
Особенности: с осторожностью назначается пациентам с кардиальной патологией, стенокардией, глаукомой, почечной недостаточностью.
Предостережения: при первых днях приема возможны тошнота, рвота, что головокружение, астения, бессонница, повышенная возбудимость, повышение АД, гиперемия кожи и др.
Элиминация: подвергается метаболизму в печени с образованием неактивных метаболитов, которые выводится почками.
Пластырь с 5% лидокаином (Версатис)
Назначается в качестве препарата первой линии при локальных невропатиях с преобладанием болевых расстройств кожной чувствительности (зонах аллодинии , гипералгезии, патологичекиго зуда и др.)
Доза: от 1 до 3 пластырей, на 12 часов с последующим перерывом на 12 часов.
Особенности: не токсичен, не имеет лекарственных взаимодействий, поскольку лидокаин не попадает в системный кровоток.
Предостережения: не следует апплицировать на поврежденную поверхность кожи.
Ламотриджин (ламиктал).
Разовая доза 25-50 мг, суточная 200-400мг.
Особенности: с осторожностью назначается пациентам с почечной недостаточностью.
Предостережения: Сонливость, чувство усталости, головокружение, мышечная слабость, тревога, временное повышение активности трансаминаз в сывороткеи др.
Элиминация: метаболизируется до глюкуронидов, которые выводятся с мочой, около 10% активного вещества выделяется с мочой в неизмененном виде.
Тизанидин (сирдалуд)
Разовая доза 2-4 мг, суточная 4-6 мг.
Особенности: возможно развитие мышечной слабости, гипотонии (при применении малых доз), с осторожностью назначается пациентам с почечной недостаточностью.
Предостережения: возможно усиление действия антигипертензивных средств (гипотония и брадикардия); избыточное расслабления сфинктеров мочевого пузыря.
Элиминация: подвергается частичному метаболизму в печени, выводится преимущественно почками.
Адъювантная терапия хронического болевого синдрома у онкологических больных.
Кроме антиконвульсантов и антидепрессантов в качестве дополнительных аналгетиков в онкологии применяются кортикостероиды, транквилизаторы, антигистаминные средства. Кортикостероиды (дексаметазон, преднизолон) за счет противовоспалительного и противоотечного действия оказывают определенный аналгетический эффект. Предпочтение оказывают дексаметазону из-за менее выраженного минералокортикоидного эффекта. Кроме того, отмечено, что кортикостероиды оказывают некоторое положительное влияние на настроение пациентов. Наиболее показаны при опухолях и метастазах в головной мозг с повышением внутричерепного давления, при поражении костей, спинного мозга, нервных сплетений, печени, при опухолях малого таза и забрюшинного пространства, при обструкции лимфатических протоков с явлениями отека и др.
Средние дозы дексаметазона составляют 6-8 мг/сутки, при поражении нервных структур, например, компрессии спинного мозга могут доходить до 96 мг/сутки с последующим снижением. Терапия кортикостероидами может проводиться с постепенным снижением дозы в случае уменьшения боли, либо постоянно вплоть до кончины пациента. Применение кортикостероидов связано с риском ряда побочных эффектов: инфекции, миопатия, диабет, артериальная гипертензия, кровотечения из ЖКТ, психические нарушения.
В целом ряде случаев в комплексной терапии боли можно использовать местные анестетики. Существующие в настоящее время формы – трансдермальные пластыри и кремы с лидокаином (Версатис, EMLA) позволяют эффективно устранять или уменьшать болевой синдром при поверхностных поражениях.
Кроме основных анальгетических препаратов в терапии боли используют транквилизаторы, мышечные релаксанты, нейролептики, спазмолитики, бисфосфонаты.
Противоопухолевая терапия
Противоопухолевая терапия является основным этиотропным фактором в терапии онкологической боли. Ее эффективность практически сразу отражается на снижении интенсивности боли. Лучевая терапия является методом выбора у большинства пациентов с локальной болью вследствие роста опухоли, а также часто применяется при метастазах в кости, головной мозг, лимфатические узлы, эпидуральное пространство и сплетения [14]. При костных метастазах применяется системное введение изотопов (стронций-89, самарий). От химиотерапии также можно ожидать аналгетического эффекта, реализуемого вследствие уменьшения размеров опухоли, противовоспалительного эффекта и блокады болевых нейротрансмиттеров. Наименьший эффект лучевая и химиотерапия оказывают при невропатической боли. Следует также оговориться, что данные способы лечения могут сами в свою очередь способствовать появлению или усилению болевого синдрома из-за появления осложнений (после лучевой терапии - постлучевая невралгия, эзофагит и др., после химиотерапии - невропатии, миалгии).
Нефармакологические методы терапии боли.
Из нефармакологических методов, являющихся дополнением к основной терапии, используют чрезкожную электронейростимуляцию (ЧЭНС), как простую, безопасную и относительно недорогую. ЧЭНС позволяет получить эффект на срок от 2-х до 4-х недель.
Кроме этого применяются психотерапевтические техники - прогрессивная мышечная релаксация, гипноз, методы биологической обратной связи.
Регионарная аналгезия.
Применение центральных (эпидуральная и спинальная) и периферических блокад местными анестетиками является дополнением к системной терапии и целесообразно при возникновении опиоидной резистентности или выраженных побочных эффектах опиоидов. В этих случаях методики длительной катетеризации эпидурального пространства с подкожным имплантированием катетера могут улучшить качество обезболивания и жизни.
Для введения используют как опиоиды (в сочетании или без местных анестетиков), так другие аналгетики (клофелин). Недостатком центральных регионарных блокад является относительная сложность выполнения процедуры, необходимость специализированного ухода, и риск ряда осложнений, в том числе серьезных (эпидурит, менингит, пункция сосудов, пункция субарахноидального пространства), что ограничивает широкое применение данных методик.
Невролизис осуществляется растворами фенола или спирта, которые вводятся эпидурально и разрушают ноцицептивные волокна в задних корешках спинного мозга. Для субарахноидального введения, симпатической блокады и периферического невролизиса используют 50-100% раствор спирта, для субарахноидальной, эпидуральной блокад и периферического невролизиса - 5-15% раствор фенола. Степень деструкции нервных волокон зависит от концентрации раствора, при частичном поражении нервов через несколько месяцев наступает регенерация волокон, что при образовании неврином может вызывать дизестезии и боли. Невролизис позволяет обеспечить обезболивание на срок от нескольких недель до нескольких месяцев. Невролизис предпочтителен при локализации поражения в грудном отделе, т.к. ассоциируется с меньшим количеством побочных эффектов. Выполнение невролизиса в шейном и поясничном отделе чаще приводит к двигательным расстройствам и дисфункции сфинктеров. У пациентов с уже имеющимися проблемами в этой области (парез или плегия нижних конечностей, наличие колостомы или нефростомы) наступление возможных осложнений менее критично и, поэтому, поясничный невролизис в таких условиях вполне правомочен. Из других осложнений невролизиса необходимо указать на гипотензию, токсические реакции при случайном внутривенном или субарахноидальном введении препарата, пневмоторакс при некорректном введении иглы. Кроме того, невролизис в определенном проценте случаев вызывает болезненные невропатии (чаще при введении спирта). Все это ограничивает его применение в основном группой тяжелых пациентов с ожидаемым коротким сроком жизни.
Другие инвазивные методы
Несмотря на широкий спектр фармакологических препаратов у некоторых пациентов для устранения боли все же возникает необходимость в применении хирургических методов. Увеличение доз аналгетиков влечет за собой рост побочных эффектов, что в свою очередь, с целью их купирования требует назначения других лекарств (психостимуляторов, антиэметиков, слабительных и т.д.). В таких ситуациях может быть целесообразным выполнение определенных минимально инвазивных вмешательств, таких, как вертебропластика, кифопластика или радиочастотная абляция при метастазах в позвоночник [8].
Рис.1 Алгоритм диагностики хронического болевого синдрома у онкологических больных онкологического генеза
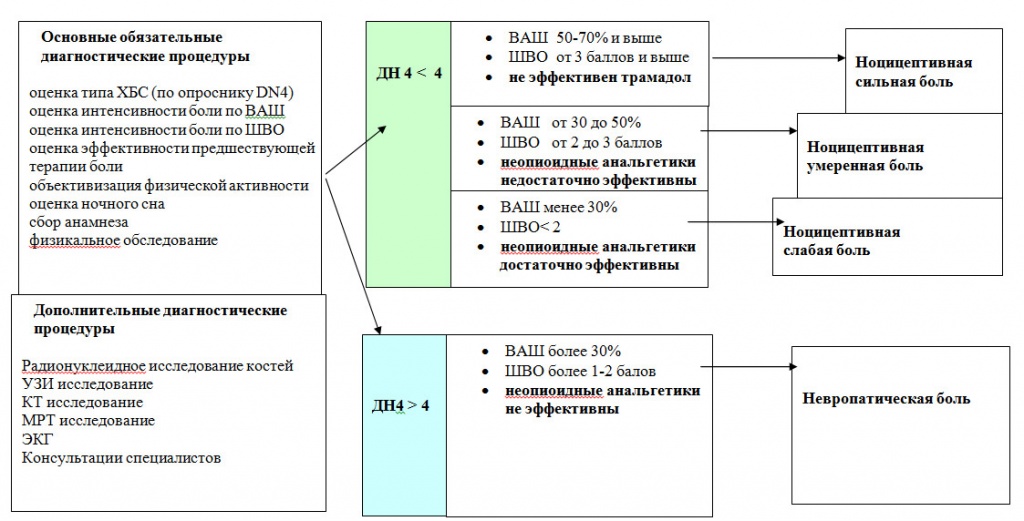
Рис. 3 Алгоритм фармакотерапии ноцицептивного хронического болевого синдрома слабой интенсивности (1-ая ступень)
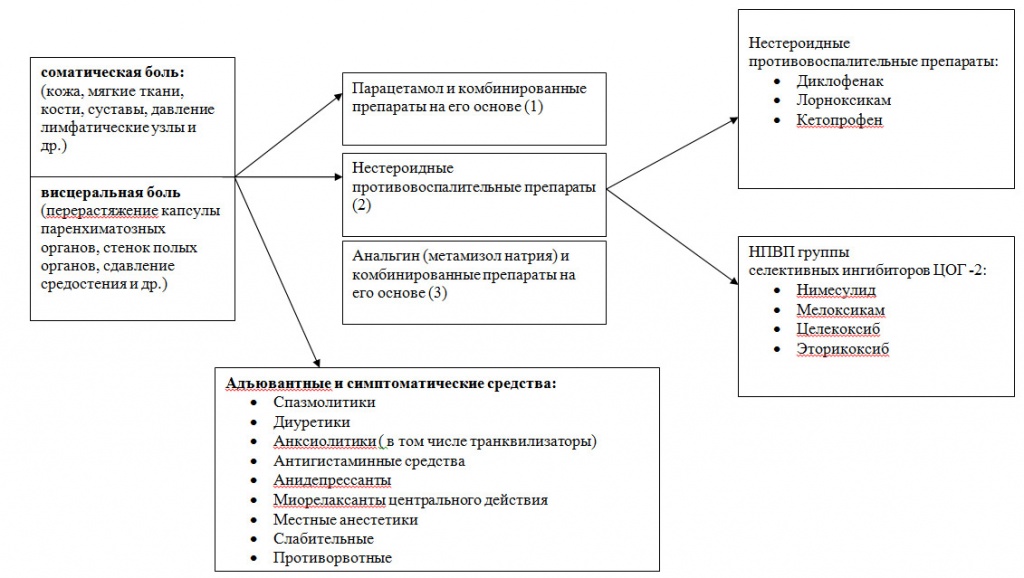
Рис. 4 Алгоритм фармакотерапии ноцицептивного хронического болевого синдрома умеренной интенсивности (2-я ступень)
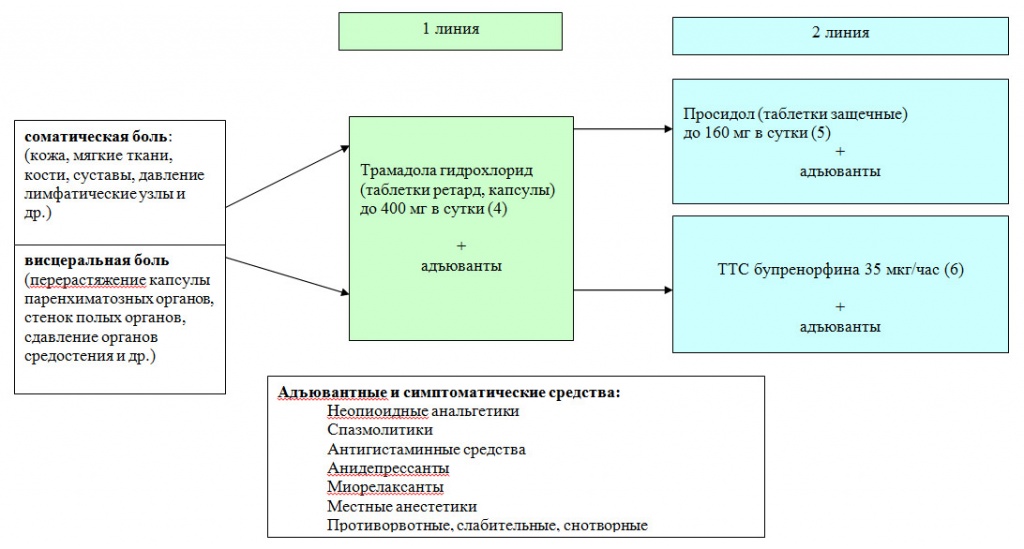
Рис. 5 Алгоритм фармакотерапии ноцицептивного сильного хронического болевого синдрома (3-я ступень)
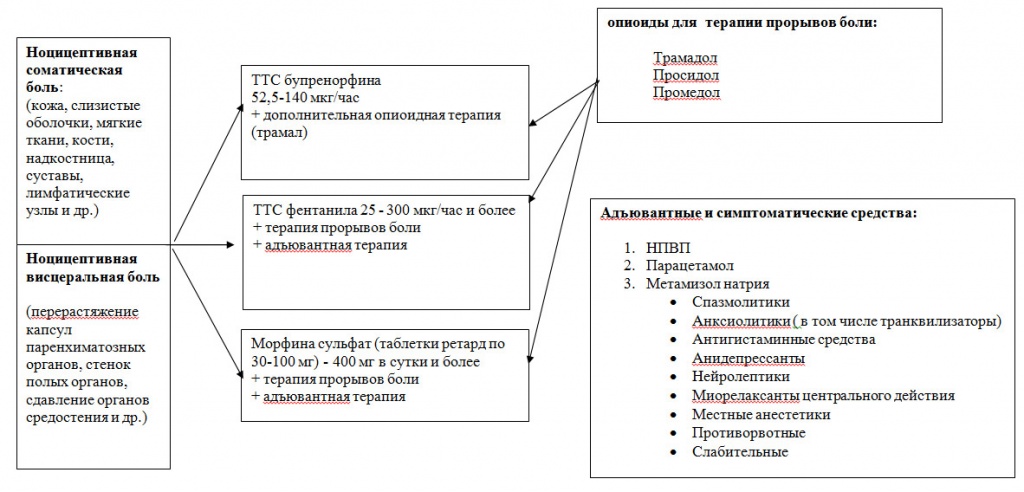
Рисунок 6. Фармакотерапия невропатического компонента хронического болевого синдрома в онкологии.