- Информация об обществе
- Регистрация в РОИБ
- Конференции
- Российские конференции
- Международные конференции
- Архив российских конференций
- Регистрация на конференцию РОИБ
- Регистрация на вебинары
- Условия НМО
- Образовательные программы
- Клинические рекомендации
- Специалистам
- Справочные материалы и руководства
- Послеоперационная боль
- Организация противоболевой помощи
- Фундаментальные аспекты боли
- Мигрень
- Головные и лицевые боли
- Невропатические боли
- Боль в спине
- Висцеральная боль
- Болевые синдромы в онкологической практике
- Боль в гематологии
- Этика боли
- Ссылки на полезные источники информации
- Опросники и шкалы для оценки боли
- Профилактика боли
- Центры, клиники и кабинеты по лечению и изучению боли
- В помощь пациенту
- Контакты
Главная >Публикации
Взаимосвязь между уридином и метаболизмом веществ
The Role of Uridine in Health and Disease Journal of Inflammation
Congkuan Song Zhen-Juan Liu, Bangjun Xu, Rui Zou, Weidong Hu/ Research 2025:18 10163–10179.Уридин играет важную роль в качестве ключевой биомолекулы в поддержании здоровья и лечении заболеваний. Здесь мы собираем и суммируем большой объем данных о важной роли уридина в здоровье, болезнях и лечении за последние 30 лет, проводим всестороннее и углубленное обсуждение и даем уникальные знания и обзор текущей ситуации и трудностей применения уридина в лечении заболеваний. Цель обзора — предоставить новые перспективы и последствия для исследований уридина и содействовать дальнейшему применению уридина в медицинской области.
Взаимосвязь между уридином и метаболизмом веществ
Уридин может играть роль в различных биосинтетических процессах, преобразуюсь в другие биоактивные молекулы, таким образом, обладая множественными биологическими функциями.
Рисунок. Взаимосвязь между уридином и метаболизмом веществ. 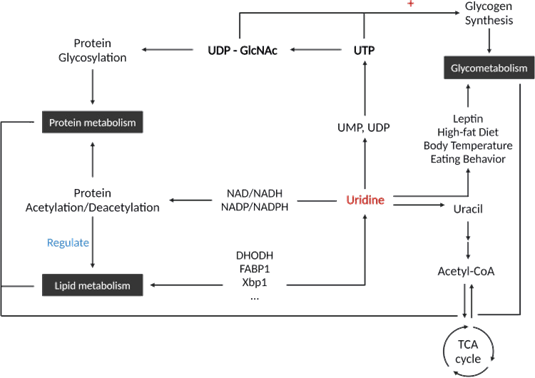
С одной стороны, уридин может участвовать в гликозилировании белков посредством образования уридиндифосфата N-ацетилглюкозамина (UDP-GlcNAc).
С другой стороны, уридин также может способствовать биосинтезу фосфолипидов клеточной мембраны путем преобразования его в цитидинтрифосфат (ЦTP).
Кроме того, уридин также регулирует биологический ритм, включая ритм температуры тела и циркадный ритм.
Метаболизм уридина и липидов
Уридин тесно связан с липидным обменом, а конкретный механизм его действия сложен и требует дальнейшего изучения.
Связь между уридином как промежуточным продуктом метаболизма пиримидинов и липидным обменом широко подтверждена. Дигидрооротатдегидрогеназа (ДГОДГ) - фермент, связывающий дыхательную цепь с мембраной митохондрий, играет важную роль в процессе метаболизма пиримидинов. Ослабление ферментативной активности ДГОДГ может привести к микровезикулярной жировой деформации, и это состояние может быть купировано добавлением уридина.
Уридин и жир тесно связаны, и оба метаболизируются через гепатобилиарный путь. Уридин синтезируется в жировой ткани во время голодания, и его уровни влияют на стабильность липидов крови.
Кратковременное добавление уридина предотвращает лекарственно-индуцированное накопление жира в печени, в то время как длительное экзогенное добавление уридина вызывает жировую болезнь печени. Сообщалось, что длительное поступление уридина подавляет экспрессию печеночно-специфического белка1, связывающего жирные кислоты (FABP1), что может быть важной причиной жировой болезни печени, а именно, длительное поступление уридина может быть движущей силой жировой болезни печени. Кроме того, белок1, связывающий X-бокс (Xbp1), играет роль в метаболизме уридина и активируется в ответ на ЭР-стресс (стресс эндоплазматического ретикулума) в жировой ткани. Его сверхэкспрессия может увеличивать синтез уридина и подавлять накопление жира. Другим примером влияния уровня уридина на стабильность липидов является то, что ингибирование UPase2 (уридинфосфорилазы 2) подавляет накопление липидов в печени, вызванное лекарственными средствами, за счет повышения концентрации эндогенного уридина в печени. Кроме того, было показано, что уридин может изменять соотношение НАД + /НАДН и НАДФ + /НАДФН в печени и регулировать профиль ацетилирования белков для регуляции липидного обмена.
Метаболизм уридина и глюкозы
Уридин как предшественник УТФ и УДФ-глюкозы может активировать синтез гликогена.
Лептин - это белковый гормон, секретируемый жировой тканью. Его основная функция - регуляция энергетического баланса, подавление аппетита и уменьшение накопления жира в адипоцитах. Сообщалось, что уридин влияет на метаболизм глюкозы через лептин. А именно, добавление уридина улучшало толерантность к глюкозе у мышей на диете с высоким содержанием жиров. В то время как в отсутствие лептина добавление уридина ухудшало толерантность к глюкозе. Также сообщалось, что уридин влияет на сигнализацию инсулина и профили толерантности к глюкозе. Более того, длительное добавление уридина приводит к повышению уровня глюкозы в крови и инсулинорезистентности. Однако в условиях диеты с высоким содержанием жиров добавление уридина снижает уровень глюкозы в крови. Это говорит о том, что регуляция метаболизма глюкозы уридином зависит от уровня калорий в рационе.
Повышенный уровень лептина, связанный с диетой с высоким содержанием жиров, может способствовать двойному эффекту уридина на толерантность к глюкозе. Кроме того, было показано, что добавление уридина в высоких дозах может снижать температуру тела грызунов, и уридин, вероятно, является движущей силой терморегуляции во время голодания и возобновления кормления, что, несомненно, является ещё одним убедительным доказательством связи уридина с метаболизмом глюкозы.
МЕТАБОЛИЧЕСКИЕ ЗАБОЛЕВАНИЯ
Жировая болезнь печени
Печень – орган, наиболее подверженный эктопическому накоплению липидов. Нарушение гомеостаза уридина тесно связано с накоплением липидов в печени. Экзогенное добавление уридина подавляло стеатоз печени, вызванный несколькими препаратами, такими как такацитабин, фенофибрат и тамоксифен. В качестве альтернативы, в мышиной модели добавление уридина смягчало ожирение и неалкогольную жировую болезнь печени, вызванные диетой с высоким содержанием жиров, путем регулирования микробиоты кишечника.
Сахарный диабет
Развитие диабета тесно связано со снижением чувствительности к инсулиновому сигналу, и исследования показали, что уридин может повышать чувствительность к инсулину, подавляя воспалительные реакции и окислительный стресс. В то же время уридин снижал уровень глюкозы в крови, улучшал толерантность к глюкозе и предотвращал диабетическое повреждение миокарда у мышей. С точки зрения механизма действия уридин защищает от диабетического повреждения функции и структуры митохондрий сердца, а также от нарушения системы контроля качества митохондрий в диабетическом сердце.
Ожирение
Ожирение является метаболическим заболеванием, вызванным избыточным накоплением жира. Было показано, что ритм уридина после еды нарушается у мышей, питающихся пищей с высоким содержанием жиров или страдающих ожирением, и добавление уридина может снизить аномальные уровни уридина при ожирении или диете с высоким содержанием жиров, тем самым смягчая ожирение. Дэн и др. обнаружили, что повышение и поддержание уровня уридина в плазме, вызванное голоданием, критически зависят от адипоцитов. Значительное повышение уровня уридина наблюдалось в жировых биоптатах ВИЧ-инфицированных пациентов с липодистрофией, что указывает на то, что избыточная продукция уридина может способствовать потере жировой ткани. Повышение уровня уридина в плазме при голодании зависит от биосинтеза пиримидина в адипоцитах, который происходит одновременно с высоким уровнем липолиза. Однако неясно, связаны ли эти два процесса механически в адипоцитах. Повышение уровня уридина в плазме крови необходимо для снижения температуры тела во время голодания. При голодании адипоциты отвечают за синтез уридина. С одной стороны, при увеличении синтеза уридина увеличивается теплоотдача, температура тела понижается, а жировая масса уменьшается. С другой стороны, активация синтеза уридина в адипоцитах во время голодания также является потенциальным механизмом запуска мобилизации триацилглицеридов, процесса, который может снижать жировую массу.
В дополнение к хранению энергии, жировая ткань секретирует лептин, который тесно связан с возникновением и развитием ожирения. Xbp1 является фактором транскрипции, участвующим в реакции ЭР на стресс, и его сверхэкспрессия увеличивает синтез лептина и уридина и подавляет накопление жира. В то время как адипозолиз индуцирует экспрессию Xbp1 в адипоцитах, что формирует циркуляторный механизм, который ускоряет потерю жировой массы. Сообщалось, что CAD (CAD-белок - крупный многофункциональный ферментный комплекс у эукариот, катализирующий первые три стадии биосинтеза пиримидиновых нуклеотидов), как фермент, ограничивающий скорость биосинтеза уридина, эффективно активируется Xbp1, что позволяет предположить, что потеря жировой массы, вызванная Xbp1, зависит от биосинтеза пиримидинов. Эти данные свидетельствуют о том, что стимуляция пути синтеза уридина в адипоцитах может быть перспективной потенциальной терапевтической целью при ожирении.
Роль уридина в регуляции иммунитета
The Role of Uridine in Health and Disease Journal of Inflammation
Congkuan Song Zhen-Juan Liu, Bangjun Xu, Rui Zou, Weidong Hu/ Research 2025:18 10163–10179.
Роль уридина в регуляции иммунитета.
Уридин играет важную роль в регуляции иммунитета. Он участвует в регуляции иммунных сигнальных путей, что может влиять на выработку и высвобождение воспалительных цитокинов, таких как ФНО-α и ИЛ-1β, тем самым смягчая воспалительную реакцию и гиперактивацию иммунной системы (Conti F, 2023).
Всё больше данных свидетельствует о том, что уридин критически важен для поддержания клеточной функции и энергетического обмена (Le TT, 2013). Уридин также оказывает регулирующее действие на энергетический обмен иммунных клеток, что критически важно для поддержания их метаболической активности, повышения их энергообеспечения и функциональной эффективности (Li L, 2019).
Уридин может модулировать функцию иммунной системы и усиливать иммунитет организма, что может быть связано с важной ролью уридина в поддержании нормализации структуры и функции митохондрий (Willyard C., 2020). Митохондрии занимают критическое положение в иммунобиологии не только с точки зрения биоэнергетической функции, но также в метаболизме и сигнализации иммунных клеток (Mills EL, 2017). Митохондрии считаются основными регуляторами метаболизма Т-клеток, поскольку они могут регулировать различные этапы адаптивного ответа Т-клеток (Desdin-Mico G, 2017). Иммунная система, и особенно Т-клетки, нуждается в функциональной митохондриальной дыхательной цепи (Tarasenko TN, 2017). Считается, что уридин регулирует митохондриальную дыхательную цепь через дигидрооротатдегидрогеназу для нормализации структуры и функции митохондрий. Исследование, проведённое Battaglia и соавторами, показало, что добавление уридина защищает пролиферативную способность Т-клеток от токсичных для митохондрий антибиотиков (Battaglia S., 2021).
Помимо классической роли синтеза генетического материала, уридин также может преобразовываться во множество других биоактивных молекул, выполняя многоцелевые функции. Ряд исследований показал, что внеклеточные нуклеотиды (АТФ, УДФ и т. д.) могут действовать как иммуномодулирующие медиаторы во время воспалительных реакций, связываясь с пуринергическими рецепторами P2 (такими как P2Y6), которые могут высвобождаться повреждёнными клетками для активации иммунного ответа в условиях воспаления (Vitiello L., 2012; Li R., 2014, Le Duc D., 2017). Несколько исследований также продемонстрировали, что уридин устраняет митохондриальную токсичность, вызванную антиретровирусной терапией у ВИЧ-инфицированных пациентов (McComsey GA, 2010; Venhoff N, 2010). Эти результаты, несомненно, указывают на тесную связь между уридином и иммунитетом.
Антиоксидантное действие уридина
The Role of Uridine in Health and Disease Journal of Inflammation
Congkuan Song Zhen-Juan Liu, Bangjun Xu, Rui Zou, Weidong Hu/ Research 2025:18 10163–10179.
Антиоксидантные свойства уридина
Уридин — это нуклеозид в структуре РНК, состоящий из урацилового основания и рибозы. Он играет важную роль не только в синтезе нуклеиновых кислот, но и потенциально важен для поддержания окислительно-восстановительного баланса клеток и антиоксидантной защиты. Сообщалось, что уридин вызывает изменения соотношений НАД/НАДН и НАДФ/НАДФН. Это важные коферменты для клеточного метаболизма, окислительно-восстановительных и антиоксидантных процессов, а также ключевые факторы поддержания окислительно-восстановительного состояния клеток (Le T.T., 2013, Canto C., 2012).
Кроме того, уридин также регулирует активность антиоксидантных ферментов и функцию митохондрий для поддержания своих антиоксидантных свойств. Было обнаружено, что уридин усиливает активность антиоксидантных ферментов, таких как супероксиддисмутаза (СОД) и глутатионпероксидаза (ГП), тем самым усиливая клеточную защиту от АФК. (Ye J., 2022; Krylova I.B., 2021; Xu R., 2022).
Митохондрии являются основными местами производства ROS в клетках, и уридин, как полагают, регулирует митохондриальную дыхательную цепь через DHODH, нормализуя структуру и функцию митохондрий. Кроме того, производное уридина UDP, действуя как активатор митохондриального АТФ-зависимого калиевого канала (mitoK АТФ ), может активировать цикл калия в митохондриях, что приводит к умеренному разобщению митохондрий и ингибированию продукции ROS. (Ye J, 2022; Krylova IB, 202110 , Bul’On VV, 2014, Krylova IB, 2012, Krylova IB, 2006).
Уридин также способен влиять на множественные пути передачи сигнала, включая NF-κB и MAPK, Nrf 2, которые тесно связаны с клеточным ответом на окислительный стресс. Регулируя эти пути, уридин помогает поддерживать антиоксидантное состояние внутри клеток (Xu R., 2022; Mironova G.D., 2018; Jiang N., 2022, Luo Y., 2021). Более того, хотя уридин относительно слабо проявляет свою способность напрямую связывать свободные радикалы, он может косвенно участвовать в очистке от активных форм кислорода (ROS) путем преобразования в другие антиоксидантные молекулы (Connolly G.P., 2018).
Уридин как нейропротектор
The Role of Uridine in Health and Disease Journal of Inflammation
Congkuan Song Zhen-Juan Liu, Bangjun Xu, Rui Zou, Weidong Hu/ Research 2025:18 10163–10179.
Нейропротекторные эффекты уридина
Защитное действие уридина на нервную систему многогранно. Во-первых, противовоспалительные и антиоксидантные свойства уридина могут защищать различные клетки, включая нервные клетки, от воспаления и окислительного повреждения (Lecca D, 2007).
Во-вторых, уридин является предшественником синтеза ЦДФ-холина (Yang Q, 2018). В нервной системе ЦДФ-холин участвует не только в построении и поддержании клеточных мембран, но также связан с синтезом нейротрансмиттеров (Adibhatla R.M., 2005; Haam J., 2017). Например, холин является предшественником синтеза ацетилхолина (АХ), который является ключевым нейротрансмиттером в центральной и периферической нервной системе, задействуя различные когнитивные функции, такие как обучение, память и внимание. Более того, ЦДФ-холин также может оказывать влияние на нейродегенеративные заболевания и процессы восстановления после повреждения нерва, влияя на биологический метаболизм липидов и клеточную сигнализацию в нервных клетках (Caner B., 2012; Aslan E., 2012; Secades J.J., 1995). ЦДФ-холин в животных моделях демиелинизирующих заболеваний, таких как рассеянный склероз, демонстрирует потенциал для стимуляции ремиелинизации и восстановления нервов (Gudi V., 2023).
Кроме того, исследование Choi и коллег отметило, что уридин защищает корковые нейроны от гибели, вызванной дефицитом глюкозы, что может быть связано с ролью уридинфосфорилазы (Choi JW, 2008). Это говорит о том, что уридин может оказывать нейропротекторное действие посредством специфического ферментативного действия. Уридин также был способен смягчать вызванное морфином обусловленное предпочтение места и модулировать уровни глутамата/γ-аминомасляной кислоты в префронтальной коре мышей (Liu P., 2017). Уридин также может оказывать противоэпилептическое действие на судороги, регулируя высвобождение дофамина и экспрессию рецепторов (Wang T., 2018; Page T. , 1997).
С другой стороны, нейропротекторное действие отражается в роли уридина в энергетическом метаболизме и процессах восстановления клеток. Он улучшает энергоснабжение за счет усиления функции митохондрий и защищает нейроны от метаболического стресса (Mironova GD, 2018). Нейропротекторное действие уридина также коррелировало со снижением апоптоза (Lecca D., 2008; Khezri MK, 2021).

В целом, нейропротекторное действие уридина представляет собой многогранный, многоуровневый процесс, включающий множество звеньев, включая антиоксидантную защиту, регуляцию иммунитета, энергетический обмен веществ и восстановление клеток, а также противодействие апоптозу.
Эффективность уридинмонофосфата, ацетил-L-карнитина и альфа-липоевой кислоты в лечении боли при хронической невропатии и радикулопатии: обзор литературы и пилотное наблюдательное исследование по радикулопатии
Marcella Curone and Vincenzo Tullo (2023)
Casa di Cura Privata del Policlinico Igea Headache Center Via Marcona 69, 20129 Milan, ItalyEfficacy of Uridine Monophosphate, Acetyl-L-Carnitine and Alpha Lipoic Acid in the Treatment of Pain in Chronic Neuropathy and Radiculopathy: A Review of the Literature and an Observational Pilot Study on Radiculopathy J. Case Rep. Med. Hist 3(8)
doi https://doi.org/10.54289/JCRMH2300136
Абстракт.
За последние 10 лет выросла роль и популярность нутрицевтиков как дополнительных средств для лечения хронической боли. Уридинмонофосфат, а также ацетил-L-карнитин и альфа-липоевая кислота показали эффективность в лечении боли, обусловленной невропатиями и симптоматическими периферическими компрессиями нервов. На основе приведенных доказательств эффективности этих ингредиентов в лечении невропатий, в данной публикации представлено наблюдательное пилотное исследование по оценке эффективности комбинации уридинмонофосфата, ацетил-L-карнитина и альфа-липоевой кислоты в уменьшении боли при хронической радикулопатии.
Материалы и методы. В исследование были включены 60 пациентов (20 мужчин, 40 женщин) в возрасте от 18 до 65 лет. Все пациенты соответствовали следующим критериям включения: 1. клинический диагноз хронической поясничной или шейной радикулопатии, 2.наличие хронической боли, оцененной по визуальной аналоговой шкале боли (ВАШ) от 6 до 10, 3. Наличие электромиографических доказательств радикулопатии на этапе включения в исследование.
Пациенты были рандомизированно распределены на две группы: основная группа - 30 пациентов (9 мужчин, 21 женщина), получала терапию в виде комбинации уридинмонофосфата, ацетил-L-карнитина и альфа-липоевой (в суточной дозировке *** мг/день, 1000 мг/день и 600 мг/день соответственно) в течение 4-х месяцев. В контрольную группу без лечения были включены 30 пациентов (** мужчин, 19 женщин) В рамках исследования было три визита: первый визит при включении (Т0), второй визит через 3 месяца (Т90) и заключительный визит через 4 месяца от начала исследования (Т120). Эффективность терапии оценивалась на основании показателей динамики ВАШ (T0, T90 и T120) и ЭМГ (Т0, T120).
Результаты.
Группа, получавшая комбинацию уридинмонофосфата, ацетил-L-карнитина и альфа-липоевой кислоты.
На втором визите (T90) через 3 месяца у 93% (28/30) пациентов наблюдался положительный ответ на лечение в виде снижения ВАШ боли, по крайней мере, на 3 балла, и только у 7% (2/30) пациентов не наблюдалось ответа на лечение (по крайней мере, на 1-2 балла). Через 4 месяца лечения (визит T120) у 93% (28/30) пациентов сохранялась положительная динамика ВАШ боли со снижением ВАШ, по крайней мере, на 3 балла, а у 7% (2/3) не наблюдалось ответа на лечение. Снижение показателя ВАШ между T0 и T90 было статистически значимым (тест Уилкоксона < 0,001). Улучшение показателя ВАШ было стабильным на третьем визите (нет значительных различий между T90 и T120, тест Уилкоксона =1). По окончании исследования (Т120) 90% (27/30) пациентов выполнили повторную ЭМГ, по результатам которой у 11% (3/27) наблюдалось улучшение параметров по сравнению со стартовой ЭМГ.
Контрольная группа.
В противоположность основной группе в контрольной группе на 2-м визите через 3 месяца наблюдения (T90) у 90% (27/30) пациентов не наблюдалось никаких изменений в уровне боли по ВАШ. Только у 1 из 30 (3%) пациентов наблюдалось спонтанное улучшение на 4 балла по ВАШ после физиотерапии. У 2 из 30 (7%) пациентов наблюдалось ухудшение боли. На третьем визите через 4 месяца наблюдения (T120) у 86,6% (26/30) пациентов не наблюдалось никаких изменений в уровне боли; у 3,4% (1/30) продолжалось спонтанное и стабильное улучшение по ВАШ, у 10% (3/30) наблюдалось ухудшение боли. ЭМГ по окончании наблюдения выполнили 63% (19/30) пациентов, ни у кого из них не было отмечено улучшения параметров ЭМГ через 120 дней наблюдения.
Заключение. Данные, представленные в исследовании, показали, что применение комбинации уридинмонофосфата, ацетил-L-карнитина и альфа-липоевой кислоты у пациентов, страдающих радикулопатией, привело к значительному уменьшению боли и статистически значимому улучшению, Кроме того, улучшение боли было стабильным и через 120 дней от начала лечения.
Старение кишечника замедляется уридином посредством регуляции воспаления и окислительного стресса in vivo и in vitro
Na Jiang and Zhiwei Zhao. Intestinal aging is alleviated by uridine via regulating inflammation and oxidative stress in vivo and in vitro./ CELL CYCLE 2022, VOL. 21, NO. 14, 1519–1531
https://doi.org/10.1080/15384101.2022.2055252
Краткий обзор публикации.
Физиологические функции человеческого организма начинают снижаться со старением, и кишечный тракт как важнейший пищеварительный орган также стареет. Как облегчить или обратить вспять старение — важная научная проблема. В данном исследовании авторы оценили антивозрастной эффект уридина, используя кишечные клетки в качестве модели in vitro и старых мышей в качестве модели in vivo . Для оценки антивозрастного эффекта уридина были использованы методы вестерн-блоттинга, непрямой иммунофлуоресценции и иммуногистохимии.
На модели клеток in vitro исследователи обнаружили, что уровень старения кишечного тракта был значительно снижен уридином: применение уридина снизило уровень Sa-β-gal-положительных клеток (клеток, которые проявляют повышенную активность фермента бета-галактозидазы, ассоциированной со старением). Уровень экспрессии маркеров старения клеток (P15 и P16) был значительно снижен. Кроме того, на фоне уридина уровни воспаления и окислительного стресса также были значительно снижены (а именно, экспрессия мРНК, интерлейкина-6 (ИЛ-6) и ИЛ-1β). Исследователи проанализировали потенциальные молекулярные механизмы, с помощью которого уридин может подавить воспаление. В результате было установлено, что при лечении уридином были снижены сигнальные пути, связанные с воспалением (NFκB, p38, MAPK и JUK).
Далее в ходе экспериментов in vivo исследователи обнаружили, что уровень старения кишечника мышей, получавших уридин, был значительно ниже, чем у животных контрольной группы, что было продемонстрировано с помощью иммуногистохимических методов и вестерн-блоттинга.
В заключение авторы отметили, что их текущие исследования показывают, что уридин демонстрирует хороший эффект против старения, что позволяет предположить, что уридин можно будет использовать в качестве здорового питания или клинического препарата для лечения старения кишечника.


Рисунок. Оценка влияния уридина на кишечное старение кишечника in vivo (звездочка указывает на значительную разницу (p < 0,05).
а. Уридин значительно снизил уровень окрашивания кишечного SA-β-gal по сравнению с контрольной группой.
b. Уровни экспрессии P21 и P16 были значительно снижены при обработке уридином.
c. Уровень экспрессии IL-6 и IL-1β снижался при обработке уридином.
d. Оценка влияния уридина на кишечник с помощью окрашивания HE: уридин может увеличить толщину слизистой оболочки тонкого кишечника, длину ворсинок, но не оказывает значительного влияния на глубину крипт.
Потенциальные возможности уридина при остеоартрите
https://doi.org/10.1080/15384101.2021.2010170
Jia Ye, Zhihui Jin, Sen Chen, and Weichun Guo. Uridine relieves MSCs and chondrocyte senescence in vitvo and exhibits thepotential to treat osteoarthritis in vivo. / CELL CYCLE 2022, VOL. 21, NO. 1, 33–48
Абстракт.
Остеоартрит (ОА) — дегенеративное заболевание, встречающееся чрезвычайно часто у пожилых людей. Поэтому борьба со старением может быть важной предпосылкой для лечения ОА. Старение хондроцитов и мезенхимальных стволовых клеток (МСК) является одним из важных факторов, вызывающих ОА.
В этом исследовании влияние уридина на старение хондроцитов и МСК оценивалось в экспериментах in vivo и in vitro. Исследователи создали модель старения хондроцитов и МСК in vitro и модель ОА in vivo, а также провели ряд экспериментов (таких как CLSM, ELISA, вестерн-блот и т. д.) для оценки влияния уридина на старение хондроцитов и МСК.
Результаты оценки ряда маркеров старения показали, что уридин может облегчить старение хондроцитов и МСК in vitro. Более того, уридин также может облегчить ОА in vivo.
Подводя итог, в настоящей работе исследователи обнаружили, что уридин может облегчить старение хондроцитов и МСК в экспериментах in vitro и in vivo. Уридин показал большой потенциал в лечении ОА in vivo, что позволяет предположить, что уридин может использоваться для лечения и профилактики ОА, вызванного старением, и имеет потенциал для клинического применения в будущем.
Некоторые данные, представленные в публикации.
Влияние уридина на воспаление в стареющих клетках C-28/I2* и МСК
Изучение влияния уридина на воспаление показало, что при лечении уридином TNF-α, интерлейкин-1β (IL-1β) и IL-6 были значительно снижены. Далее исследователи изучили молекулярные механизмы, с помощью которых уридин может снимать воспаление. Для этого они проанализировали сигнальный путь, связанный с воспалением, и обнаружили, что сигнальный путь, связанный с воспалением, был ингибирован уридином в C-28/I2 и МСК. По мнению исследователей, это может быть одним из потенциальных молекулярных механизмов, с помощью которых уридин снимает воспаление.
*C28/I2: Линия клеток хондроцитов человека C28/I2, которая широко используется в качестве модельной линии клеток для изучения нормальных и патологических механизмов восстановления хряща, связанных с биологией и физиологией хондроцитов
Влияние уридина на окислительный стресс in vitro
Старение тесно связано с окислительным стрессом, оно является результатом накопления окислительного повреждения, которое обусловлено высвобождением активных форм кислорода. Как и ожидали исследователи, в эксперименте после обработки клеток H2O2 уровень окислительного стресса заметно увеличился — уровень экспрессии антиоксидантных энзимов (SOD, CAT, GSH и GPx)** был явно снижен. При этом обработка уридином значительно увеличила уровни SOD, CAT, GSH и GPx и снизила уровни ROS и MDA в C-28/I2 и MSC. Эти результаты свидетельствуют о том, что уридин оказывает антиоксидантное действие на C-28/I2 и МСК.
**SOD Супероксиддисмутаза, CAT – каталаза, GSH – Глутатион-S-трансфераза, GPx - глутатионпероксидаза
Новые экспериментальные исследования подтвердили высокий регенераторный потенциал уридина. Установлено, что:
А. Лечение уридином улучшает регенерацию нервов и функциональное восстановление при повреждении седалищного нерва у крыс (Cansu KOC et al., 2021)
Б. Эпигенетические механизмы могут частично опосредовать регенеративный эффект лечения уридином в модели повреждения седалищного нерва у крыс (Ali Imran Ozmarasali et al.,2024).
Материалы и методы: Самцы крыс Sprague-Dawley были рандомизированно распределены на 3 группы: (1) группа ложной операции (ложная операция плюс физиологический раствор), (2) контрольная группа (с перерезкой правого седалищного нерва и первичным восстановлением плюс физиологический раствор), (3) группа уридина (перерезка правого седалищного нерва с первичным восстановлением плюс 500 мг/кг уридина (группа уридина). Физиологический раствор или уридин вводили внутрибрюшинно в течение семи дней, и крыс наблюдали в течение 12 недель после операции. Оценивали электрофизиологическое и функциональное восстановление с помощью электромиографии (ЭМГ) и функционального индекса седалищного нерва (SFI) через 6 и 12 недель соответственно. Через 12 недель крыс декапитировали, и их правые седалищные нервы исследовали макроскопически и гистоморфологически.
Результаты исследования. Функциональная оценка по SFI и скорость проводимости седалищного нерва, проанализированная с помощью ЭМГ, снизились в контрольной группе, но восстановились в группе уридина через 12 недель после операции. Кроме того, по завершении эксперимента было отмечено, что лечение уридином улучшает адгезию нервов, показатели разделяемости и количество миелинизированных аксонов.
Заключение: Эти результаты показывают, что краткосрочное лечение уридином обеспечивает морфологические и электрофизиологические преимущества, которые представлены долгосрочным функциональным улучшением в модели повреждения седалищного нерва у крыс. Эти результаты подтверждают и расширяют наши знания о регенеративных эффектах уридина при повреждениях периферических нервов.


Mediation of Epigenetic Mechanisms in the Regenerative Effect of Uridine in a Rat Model of Sciatic Nerve Injury/ Ali Imran Ozmarasali, Cansu Koc, Huseyin Uzabaci, Mehmet Cansev et al. Turk Neurosurg.2024;34(6):1122-1132.
doi: 10.5137/1019-5149.JTN.45425-23.2.
Материалы и методы: 50 взрослых самцов крыс были рандомизировано распределены в 3 группы: (1) ложной операции, (2) контроля и (3) уридина. После односторонней перерезки и первичного анастомоза правого седалищного нерва в течение недели внутрибрюшинно вводили однократную ежедневную дозу физиологического раствора (1 мл/кг; ложная и контрольная группы) или уридина (500 мг/кг; группа уридина). Седалищные нервы удаляли единым блоком на 8-ой день, и в гомогенатах нервов анализировали уровни гистондеацетилазы 1 (HDAC1*), ацетилированного гистона-H3** и ацетилированного гистона-H4**. Количество миелинизированных аксонов в образцах седалищного нерва анализировали гистоморфологически.
Результаты: Уровни HDAC1 были значительно выше в контрольной группе, чем в группах с имитацией (p < 0,001) и уридином (p < 0,01). По сравнению с группой с имитацией уровни ацетилированного гистона-H3 и гистона-H4 снизились в контрольной группе (на 81,49% и 79,98% соответственно для обеих; p < 0,001) и значительно увеличились в группе с уридином (на 62,54% и 51,68% соответственно; p < 0,01, p < 0,05). Количество миелинизированных аксонов значительно снизилось (p < 0,001) в контрольной группе, но было значительно увеличено при введении уридина.
Заключение: Эпигенетические механизмы могут частично опосредовать регенеративный эффект лечения уридином в модели повреждения седалищного нерва у крыс. Эти данные предоставляют новые сведения о лечении повреждения периферических нервов и предполагают потенциальную пользу уридина при дегенеративных заболеваниях, в которых задействованы эпигенетические нарушения.
*Гистондеацетилаза1 — фермент, который у человека кодируется геном HDAC1. Осуществляет ацетилирование и деацетилирование гистонов.
** Гистоны (от греч. ἱστός «ткань») — обширный класс ядерных белков, выполняющих две основные функции: участие в упаковке нитей ДНК в ядре и эпигенетическая регуляция таких ядерных процессов, как транскрипция, репликация и репарация.


HDAC1 levels in the uridine, control, and sham groups.**p<0.01; ***p<0.001, compared to the control group (n=8)
Количество аксонов в зоне измерения. ***p<0.001 по сравнению с контрольной группой (n=8 в каждой группе);
Уридин как возможный перспективный агент для профилактики и лечения болезни паркинсона
Mironova G.D.; Mosentsov A.A.; Mironov V.V.; Medvedeva V.P.; Khunderyakova N.V.; Pavlik L.L.; Mikheeva I.B.; Shigaeva M.I.; Agafonov A.V.; Khmil N.V.; The Protective Effect of Uridine in a Rotenone-Induced Model of Parkinson’s Disease: The Role of the Mitochondrial ATP-Dependent Potassium Channel. /Int. J. Mol. Sci. 2024, 25, 7441.
doi.org/10.3390/ijms25137441 https://www.mdpi.com/1422-0067/25/13/7441Группой российских ученых Института теоретической и экспериментальной биофизики РАН под руководством заведующей лабораторией митохондриального транспорта д.б.н. профессора Мироновой Г.Д. в эксперименте на модели болезни Паркинсона установлено, что уридин защищает организм от развития этого патологического процесса.
В ходе проведенного исследования было выявлено, что экспериментальный паркинсонизм сопровождается характерным двигательным дефицитом, при этом были поражены как нейроны, так и миелиновая оболочка нервных волокон в substantia nigra. Помимо этого ученые выявили изменения энергетического и ионного обмена в митохондриях мозга.
Более ранние исследования роли митохондрий в патогенезе БП показали, что фармакологический активатор митохондриального АТФ-зависимого калиевого канала (mitoKATP) способствует защите организма от дегенерации дофаминергических нейронов [Успаленко и коллеги, 2023]. Кроме того, исследователи нашли его метаболический активатор – уридиндифосфат. Сам по себе уридиндифосфат не способен проникать в клетку, однако его концентрация в тканях может увеличиваться после введения животному уридина [Миронова и коллеги, 2018].
При введении животным с экспериментальным паркинсонизмом уридин дозозависимо уменьшал поведенческие нарушения и предотвращал гибель животных, которая наступала примерно у 50 % животных в данной модели. Уридин предотвращал нарушения окислительно-восстановительного, энергетического и ионного обменов в митохондриях головного мозга, а также устранял изменения в их структуре и миелиновой оболочке в substantia nigra. Цитохимическое исследование показало, что уридин восстанавливает показатели окислительного фосфорилирования и гликолиза в лимфоцитах периферической крови. Специфический блокатор митоКАТП-канала, 5-гидроксидеканоат, устранял положительный эффект уридина, что позволяет предположить, что этот канал участвует в нейропротекции.
Вместе взятые, эти результаты, по мнению исследователей, свидетельствуют о перспективности использования уридина в качестве нового препарата для профилактики и, возможно, остановки прогрессирования болезни Паркинсона.
Схематическое изображение защитных путей уридина.

Пуринергическая система и нейроглия: роль в болевом ответе
Джулия Магни, Стефания Черути
Giulia Magni and Stefania Cerut. Review Article. The Purinergic System and Glial Cells: Emerging Costars in Nociception.BioMed Research International, Volume 2014, Article ID 495789, 13 pages | http://dx.doi.org/10.1155/2014/495789
Абстракт и короткие выдержки из текста статьи.
В настоящее время хорошо известно, что глиальные клетки не только обеспечивают механическую и трофическую поддержку нейронов, но и могут напрямую способствовать нейротрансмиссии, например, путем высвобождения и поглощения нейротрансмиттеров и секреции про- и противовоспалительных медиаторов. Это значительно изменило наше отношение к острым и хроническим расстройствам, проложив путь для новых терапевтических подходов, нацеленных на активированные глиальные клетки для косвенной модуляции и/или восстановления нейронных функций.
Более глубокое понимание молекулярных механизмов и сигнальных путей, вовлеченных в коммуникацию нейрон-глиа и глия-глиа, на которые можно воздействовать фармакологически, является, таким образом, обязательным шагом к успеху этой новой стратегии исцеления. Это справедливо и в области передачи боли, где было четко продемонстрировано ключевое участие астроцитов и микроглии в центральной нервной системе и в сателлитных глиальных клетках в периферических ганглиях, где были идентифицированы буквально сотни сигнальных молекул. В этой публикации авторы сосредоточились на одной новой сигнальной системе, вовлеченной в перекрестные связи между нейронами и глиальными клетками, - пуринергической системе, состоящей из внеклеточных нуклеотидов и нуклеозидов и их мембранных рецепторов. В частности, авторы обобщили существующие доказательства новых «лекарственных» глиальных пуринергических мишеней, которые могли бы помочь в разработке инновационных анальгетических подходов к хроническим болевым состояниям.
1. Хроническая боль: нейронам нужны сопутствующие факторы для повышения чувствительности
Глиальные клетки напрямую участвуют в ноцицепции не только в центральной нервной системе (ЦНС), но и на периферии. Фактически, особый тип глиальных клеток, называемый сателлитными глиальными клетками (SGC), находится в периферических сенсорных ганглиях, где они окутывают тела нейронов, таким образом составляя отдельные морфологические и функциональные единицы. В последние несколько лет их центральная роль в развитии и поддержании хронической боли была четко продемонстрирована несколькими авторами, которые сообщили о повышенной экспрессии и высвобождении медиаторов, таких как интерлейкин-1 β (IL-1 β ) и фактор некроза опухоли альфа (TNF α ), а также об их повышенной связи, опосредованной щелевыми контактами, после повреждения нерва.
Установленная в настоящее время роль глиальных клеток в ноцицепции предполагает, что фармакологическое манипулирование их реактивностью может представлять собой новаторскую стратегию анальгезии, как альтернативу классическому «нейрон-центричному» подходу. Поэтому необходимо определить наиболее перспективные ключевые сигнальные пути, способствующие реакции глиальных клеток на болевую стимуляцию, которые можно было бы использовать фармакологически. Здесь мы сосредоточимся на пуринергической системе, которая в последние годы стала одной из самых инновационных и пока еще частично неизученных сигнальных систем, контролирующих функцию глиальных клеток при различных патологических состояниях, включая боль
2.Ионные рецепторы, активируемые внеклеточными нуклеотидами: семейство рецепторов P2X
Внеклеточные нуклеотиды, в основном АТФ, но, возможно, также и УТФ, хранятся в синаптических пузырьках и активно высвобождаются во время физиологической или патологической (т. е. эксайтотоксической) нейротрансмиссии. Рецепторы P2X представляют собой мембранные ионные каналы, которые открываются в ответ на связывание внеклеточного АТФ и вызывают быстрые ответы (<10 мс), что приводит к избирательной проницаемости для катионов Na + , K + и Ca 2+
3.Рецепторы P2X и хроническая боль: дело не только в нейронах
С момента первых публикаций, демонстрирующих участие АТФ в передаче боли, уровни экспрессии и функции рецепторов P2X были охарактеризованы в нейронах ганглиев задних корешков (DRG) и в тройничном нерве. Все подтипы рецепторов P2X, за исключением P2X7, экспрессируются в сенсорных нейронах; среди них подтип P2X3 показал самые высокие уровни экспрессии. На сегодняшний день наиболее важными подтипами рецепторов P2X, участвующими в передаче боли, являются (i) подтипы рецепторов P2X3 и P2X2/3, экспрессируемые сенсорными нейронами, (ii) рецептор P2X4, экспрессируемый микроглией ЦНС, и (iii) рецептор P2X7, экспрессируемый микроглией ЦНС и астроцитами, а также SGC в сенсорных ганглиях
4.Нейрональные рецепторы P2X3: ключевые игроки в ноцицепции
Нейрональный подтип P2X3, наиболее изученный подтип рецепторов P2X, участвующий в ноцицепции. Рецепторы P2X3 избирательно экспрессируются на высоких уровнях в ноцицептивных первичных сенсорных нейронах в тройничном, нодозном и дорсальном корешковых ганглиях. Избирательная экспрессия рецепторов P2X3 в этих областях, участвующих в передаче боли, предполагает, что они могут иметь решающее значение в обработке болевых сигналов, и несколько исследований оценили связь между рецепторами P2X3 и болевыми ощущениями.
5. Глиальные рецепторы P2X4 и P2X7
Связь между микроглией и нейронами является двунаправленной, и ряд доказательств указывают на то, что АТФ является важнейшей сигнальной молекулой молекулой. Экспрессия P2X-рецепторов в микроглии ограничена подтипами P2X4 и P2X7, активация которых вызывает токовые реакции, увеличивает количество АТФ в организме, увеличивает внутриклеточный [Ca2+] и вызывает высвобождение сигнальных молекул, влияющих на функции нейронов.

6. Рецепторы, сопряженные с G-белком, активируемые внеклеточными нуклеотидами: семейство рецепторов P2Y
Идентифицировано в общей сложности восемь подтипов рецепторов P2Y человека: рецепторы P2Y 1 , P2Y 2 , P2Y 4 , P2Y 6 , P2Y 11 , P2Y 12 , P2Y 13 и P2Y 14. Различные подтипы рецепторов P2Y функционально связаны с различными G-белками и, следовательно, с нисходящими сигнальными путями, либо с фосфолипазой C с образованием инозитол-3-фосфата (IP 3 ) и увеличением внутриклеточного кальция, либо с аденилатциклазой, что приводит к модуляции продукции циклического аденозинмонофосфата (цАМФ). С фармакологической точки зрения рецепторы P2Y можно в целом разделить на четыре группы в зависимости от их чувствительности к нуклеотидам: (1) рецепторы, предпочитающие адениновые нуклеотиды, в основном реагирующие на АДФ и АТФ; в эту группу входят P2Y 1 , P2Y 12 и P2Y 13 , а P2Y 11 ; (2) рецепторы, предпочитающие урациловые нуклеотиды, включая P2Y 4 и P2Y 6, реагирующие либо на УТФ, либо на УДФ; (3) рецепторы смешанной селективности (P2Y 2 , P2Y 4 и, возможно, P2Y 11 ); и (4) рецептор P2Y 14 , реагирующий как на УДФ, так и на сахарные нуклеотиды (в основном УДФ-глюкозу и УДФ-галактозу)
7. Глиальные рецепторы P2Y и хроническая боль: все еще неуловимые, но многообещающие цели для новых анальгетических стратегий
P2Y рецепторы широко экспрессируются нейронами и глиальными клетками, как в центральной, так и в периферической нервной системе, что приводит к гипотезе о том, что их активность интегрирована в сложную молекулярную сеть, связанную с передачей ноцицептивных сигналов. Поэтому понимание их роли в патогенезе боли имеет первостепенное значение для открытия новых потенциальных лекарственных мишеней для терапии боли.
Что касается рецепторов P2Y, экспрессируемых сенсорными нейронами, подтип рецептора P2Y1 часто ко-экспрессируется с рецептором P2X3, действуя как его функциональный антагонист в DRG, в то время как подтипы P2Y12,13 могут ингибировать потенциалзависимые кальциевые каналы N-типа. Взятые вместе, эти данные предполагают общий анальгетический профиль для АДФ-чувствительной активации рецептора P2Y.
Рисунок. Пластичность пуринергической сигнализации в сенсорных ганглиях при воздействии провоспалительных условий.

Схематически обобщены имеющиеся на сегодняшний день данные о модуляции экспрессии рецептора Р2 проалгогенными и провоспалительными условиями в сенсорных ганглиях. Некоторые подтипы рецепторов (например, глиальный подтип рецептора P2Y12) обнаруживаются только в альгогенных условиях. Активация P2-рецепторов внеклеточными нуклеотидами приводит к модуляции других систем, участвующих в ноцицепции, таких как рецепторы TRPV1, и к высвобождению дополнительных цитокинов, факторов роста и других веществ (см. вставку), что еще больше способствует развитию и поддержанию проалгогенной среды.
Результаты многоцентрового открытого наблюдательного исследования эффективности и безопасности применения биологически активной добавки Нейроуридин Н у пациентов с острой неспецифической болью в нижней части спины в повседневной амбулаторной практике «НейроН»
Э.З. ЯКУПОВ, С.Г. БУРД, Е.Р. БАРАНЦЕВИЧ, Р.А. ЖАМИЕВА, О.И. МЕНДЕЛЬ, А.В. ЛЕБЕДЕВА, Ю.В. РУБЛЕВА, Н.В. ПАНТИНА, Т.А. БОКИТЬКО, И.И. КОВАЛЕВА, М.А. БОГОМАЗОВА, А.П. ЕФИМЕНКО, А.Г. СМОЧИЛИН
Журнал неврологии и психиатрии им. С.С. Корсакова - 2024, т. 124, №11Первые результаты открытого рандомизированного сравнительного наблюдательного исследования «НейроН»
Баранцевич Е.Р., Якупов Э.З.
Кафедра неврологии и мануальной медицины «ФГБОУ ВО ПСПбГМУ им. И.П. Павлова» Минздрава России, г. Санкт-Петербург.
ООО «Научно-исследовательский медицинский комплекс «Ваше Здоровье» (Нейроклиника профессора Якупова), проф. Э.З.Якупов, г. Казань.Первые результаты открытого рандомизированного сравнительного наблюдательного исследования «НейроН» по оценке эффективности и безопасности БАД Нейроуридин - Н у пациентов с острой неспецифической болью в нижней части спины (Low back pain) в повседневной амбулаторной практике» по данным центра ПСПбГМУ им. акад. И.П. Павлова (г.Санкт-Петербург)
В 2023 году медицинское сообщество получило возможность использовать в практике новую форму БАД Нейроуридин Н (компания «Юнифарм»), представляющую собой комбинацию двух коанальгетиков с разными механизмами противоболевого эффекта в более высоких дозах: УМФ (200мг) и холин (100 мг ).
С целью изучения места БАД НЕЙРОУРИДИН Н в комплексной терапии острой неспецифической боли в спине в нескольких медицинских центрах РФ (ООО «Научно-исследовательский медицинский комплекс «Ваше Здоровье» (Нейроклиника профессора Якупова), проф. Э.З.Якупов (г. Казань), кафедра неврологии, нейрохирургии и мед. генетики РНИМУ им.Н.И. Пирогова, проф. С. Г. Бурд (г. Москва), кафедра неврологии и мануальной медицины ПСПбГМУ им. акад. И.П. Павлова, проф. Е.Р. Баранцевич (г. Санкт-Петербург) была проведена сравнительная оценка эффективности и безопасности БАД «Нейроуридин - Н» у пациентов с острой неспецифической болью в нижней части спины в повседневной амбулаторной практике - исследование «НейроН».
Приводим первые результаты исследования «НейроН» по данным центра ПСПбГМУ им. акад. И.П.Павлова (г.Санкт-Петербург)
К участию в исследовании были привлечены пациенты с острой неспецифической болью в нижней части спины с длительностью болевого синдрома не более 7 дней, нуждающиеся в приеме стандартной терапии НПВП (ВАШ боли более 4 баллов). Пациенты рандомно были разделены на две группы:
Группа 1: пациенты, которым был назначен НПВП (мовалис) в средних терапевтических дозах на срок от 7 до 14 дней с учетом противопоказаний и согласно клиническим рекомендациям «Рациональное использование НПВП», а также БАД «Нейроуридин-Н» на 1 капсула/день на срок 30 дней.
Группа 2: пациенты, которым был назначен НПВП (мовалис) в средних терапевтических дозах на срок от 7 до 14 дней с учетом противопоказаний и согласно клиническим рекомендациям «Рациональное использование НПВП» без использования уридинсодержащих средств.
Оценка эффективности терапии проводилась на основании динамики болевого синдрома по данным визуально-аналоговой шкалы (ВАШ), динамике изменений показателей жизнедеятельности по шкале Роланда-Морриса на 7, 14 и 30 дни наблюдения, возможности отмены НПВП на 7 и 14 дни, а также оценки удовлетворенности лечением со стороны пациента и врача.
Результаты.
В исследование были включены 34 пациента: по 17 пациентов в 1 и 2 группе.. Пациенты 1 и 2 групп были сравнимы между собой по полу, возрасту и ИМТ. Средний возраст 36,5 ±9,3 года, вес – 81 ±10,6 кг, рост – 174,6 ±8,6 см.
Динамика ВАШ боли. На фоне терапии в обеих группах исследования на всех визитах наблюдалась достоверная положительная динамика уменьшения ВАШ боли. При этом на всех визитах в группе пациентов, получавших Мовалис + Нейроуридин Н (М+НУ) отмечалось более выраженное снижение уровня боли по сравнению с группой, получавшей только Мовалис (М). На 3-м визите (через 14 дней терапии) достигнута достоверная разница ВАШ боли между группами: уровень боли был достоверно ниже в группе пациентов, получавших М+НУ по сравнению с группой, получавшей только М (2,2 балла против 3 баллов, p<0,05). Разница среднего значения ВАШ боли между 1-м и 3-м визитом составила соответственно: 5,12 баллов (снижение на 70,7%) в группе М+НУ и 3,9 баллов (на 56,7%) в группе М.
Рис.1. Динамика боли по данным ВАШ, баллы

Динамика отмены НПВП. В группе пациентов, получавших М+НУ, через 14 дней терапии прием НПВП (Мовалис) прекратили все пациенты (в 100% случаев). В группе пациентов, получавших только НПВП, на 14 день прием Мовалиса был прекращен у 2/3 пациентов (в 64,7 % случаев), Таким образом, комплексная терапия НПВП+Нейроуридин Н позволила полностью отказаться от приёма НПВП через 14 дней терапии ( p<0,05).
Таблица 1. Динамика отмены НПВП
Основная группа
М+НУ
Группа сравнения
М
Общее количество пациентов на старте терапии
17
17
Количество пациентов, не нуждающихся в приеме НПВП на 14 день терапии
17 (100%)
12 (66%)
Динамика Шкалы Роланда-Морриса.
Сходная динамика наблюдалась по данным шкалы Ролланда-Морриса. На фоне терапии в группе пациентов, получавших Мовалис+ Нейроуридин Н, отмечалась более существенная динамика улучшения жизнедеятельности уже через 7 дней терапии: улучшение на 42% (3,8 балла) против 30% (2,71 балла) у пациентов, получавших только Мовалисе. Эта динамика прослеживалась и на последующих визитах.
Рис.2. Динамика показателей шкалы Роланда-Морриса

Удовлетворенность терапией мнению пациента и врача (шкала CGI).
Динамика шкалы CGI доктор (по 5 балльной системе).
Средний балл удовлетворенности врача результатами терапии на всех визитах пациента был достоверно выше в случае использования терапии Мовалис+Нейроуридин Н, чем при лечении только НПВП, и по окончании лечения составил 5 баллов против 4,12 баллов.
Рис. 4. Динамика удовлетворенности результатами терапии, по мнению врача (средние значения CGI doctor, баллы)

Динамика шкалы CGI пациент (по 5 балльной системе).
Оценка удовлетворенностью терапией, по мнению пациента, совпала с оценкой, данной врачом. Средние значения CGI теста на всех визитах также были выше в группе Мовалис+Нейроуридин Н и по окончании терапии составили 5 баллов.
Рис. 5. Динамика удовлетворенности результатами терапии, по мнению пациента (средние значения CGI patient , баллы)

Нежелательных явлений при приеме Нейроуридина Н выявлено не было, все пациенты оценили переносимость Нейроуридин Н как хорошую или отличную.
Назначение Нейроуридина Н в дозе 1 капсула в сутки является безопасным и хорошо переносится пациентами.
Выводы:
1. Включение Нейроуридина в комплексную терапию острой неспецифической боли в спине (совместно со стандартной терапией НПВП) позволило:
(1) достичь более выраженного обезболивающего эффекта на 14 день терапии, чем в случае применения только НПВП (динамика ВАШ боли);
(2) отменить прием НПВП у всех пациентов на 14 день лечения (в 100% случаев), в отличии от группы пациентов, получавших только НПВН, у 1/3 (35%) которых сохранялась потребность в дальнейшем приеме НПВП;
(3) в большей степени улучшить жизнедеятельность пациентов, оцененную по динамике показателей шкалы Роланда-Морриса.
(4) достичь более высокой удовлетворенности результатами терапии, как со стороны врача, так и пациента.
2. Назначение Нейроуридина Н в дозе 1 капсула в сутки является безопасным и хорошо переносится пациентами. Нежелательных явлений, связанных с приемом Нейроуридин Н не выявлено.
Применение комбинации уридинмонофосфата и холина в реальной клинической практике
Рачин А.П., Шаров М.Н., Рачин С.А., Прокофьева Ю.С., Парсамян Р.Р.
«КОМОРБИДНАЯ НЕВРОЛОГИЯ №1 2024»Пуринергическая система — прошлое, настоящее и будущее в контроле боли
ЭКСПЕРТНЫЙ СОВЕТ
«Неврология сегодня №1 (19) 2023»Боль — одна из наиболее значимых проблем для системы здравоохранения и общества в целом. Пациенты с болью составляют до половины обращений в первичном звене здравоохранения Российской Федерации, около 50 % из них — пациенты с болью в нижней части спины. Адекватное обезболивание у пациентов с острой болью является первостепенной задачей, так как препятствует ее хронизации. Как таковая хроническая боль становится самостоятельным заболеванием и приводит к ряду негативных последствий, таких как нарушения сна, тревога, депрессия, ухудшение функциональных возможностей пациента, и снижению качества жизни.
Купирование острой скелетно-мышечной боли с помощью фармакотерапии, несмотря на широкий арсенал лекарственных средств, реализующих анальгетический потенциал через различные механизмы (нестероидные противовоспалительные препараты, центральные миорелаксанты, парацетамол, трамадол и др.), не всегда успешно.
Сложности фармакотерапии острой боли привели к тому, что в мире ведется активный поиск новых средств для обезболивания, обеспечивающих анальгетическое действие не только через ЦОГ-зависимые, опиоидергические, ГАМК-ергические механизмы, но и посредством вовлечения других систем. Воздействие на различные компоненты болевого ответа дает возможность более эффективно справиться с болью. Мультимодальный подход к лечению болевых синдромов рассматривается как перспективное направление в повышении эффективности и безопасности купирования боли. Он позволяет более успешно справиться с болью, сократить длительность приема НПВП или снизить их дозировку, что уменьшает риски развития побочных эффектов.
В ноябре 2022 г группа ученых провела Экспертный совет, целью которого было обсуждение роли пуринергической сигнальной системы в болевом ответе и определение места пиримидиновых нуклеотидов (уридинмонофосфата) в лечении боли. В состав Экспертного совета вошли 15 ведущих специалистов по боли из России и Казахстана. В результате работы Экспертного совета разработан Консенсус, который опубликован в «Российском журнале боли» (2023, № 1).
Консенсус Экспертного совета
«Место пиримидиновых нуклеотидов влечении боли»
Уридин, особенно его фосфорилированные формы, в частности уридинмонофосфат, следует рассматривать как перспективный коанальгетик в адъювантной терапии боли в спине.
Применение уридинсодержащего комплекса Нейроуридин представляется целесообразным:
- в качестве адъювантного средства при лечении пациентов с острой болью и обострениями хронической неспецифической боли в спине для усиления анальгетического действия НПВП, что обеспечивает улучшение результатов обезболивания, ускоряет восстановление нарушенных функций и сокращает сроки реабилитации;
- в качестве дополнительного средства для лечения пациентов с периферической невропатической болью с целью усиления обезболивания, снижения потребности в препаратах первой линии терапии невропатической боли, ускорения процессов ремиелинизации периферических нервов.
ПУРИНЕРГИЧЕСКАЯ СИСТЕМА И ХРОНИЧЕСКАЯ БОЛЬ
Михаил Львович Кукушкин, д.м.н., профессор, Москва
В 2022 г. научное сообщество отмечает юбилей — 50 лет с момента появления нового понятия «пуринергическая система». Автором его является английский нейрофизиолог и нейрофармаколог Джеффри Бернсток. Революционная для того времени гипотеза Бернстока гласила, что в автономной нервной системе помимо холинергических и адренергических нервов существуют «нехолинергические» и «неадренергические» нервы, эффекты которых не опосредуются классическими медиаторами ацетилхолином и норадреналином. Медиаторами в них служат нуклеотиды. Эти нервы Бернсток обозначил как «пуринергические». Доктор Бернсток сформулировал данную позицию» в статье «Purinergic Nervеs», опубликованной в Pharmacological Reviews в 1972 г. В последующем теория Бернстока получила широкое признание. Сегодня пуринергическая система рассматривается как один из важнейших механизмов регуляции многих функций, включая сердечно-сосудистую, нервную, иммунную, эндокринную системы. Когда мы говорим о нуклеотидах, то мы видим, что они выполняют не только энергетическую функцию, но и реализуют транспортную и пластическую функции. А главное — очень важную сигнальную функцию в межсистемном коммуницировании, во взаимодействии нервной и иммунной систем, нейрональных и глиальных клеток. Наблюдаемые изменения, возникающие в нейроглиальном взаимодействии, рассматриваются сегодня как важнейший механизм в формировании патологической боли, хронических болевых синдромов. Пуринергическая медиация в данном случае выступает «мягкой силой», которая позволяет системным образом на уровне генома клетки, на уровне взаимодействия между нейроном и ненейрональными клетками обеспечить сигнализацию и возврат к нормальным исходным позициям. Некоторые наблюдения показывают, что в принципе и АТФ, и уридин, и уридинмонофосфат, и уридинтрифосфат могут реализовывать противоболевую функцию, создавать условия для устранения той патологической сигнализации, которая может лежать в основе хронизации боли. Свойства уридина описаны в клинике и в экспериментальных исследованиях. Пуринергическая система реализует не только противоболевые эффекты, но и участвует в функционировании многих сигнальных путей, связанных с повреждением. Связь пуринергической системы с так называемыми «рецепторами врожденного иммунитета» позволяет очень четко рассматривать данное направление как возможный путь восстановления измененных функций у пациентов с хроническими болевыми синдромами.
Проводится поиск молекул, специфических агонистов и антагонистов, взаимодействующих как с аденозиновыми, так и с пуриновыми рецепторами (PX, PY). Фармакология не стоит на месте. Фармакологи создают селективные агонисты и антагонисты в надежде «поймать» ту уникальную структуру, которая обладала бы и выраженными противоболевым, и противовоспалительным свойствами и была безопасна.
Клинические исследования свидетельствуют, что естественный природный нутриент в виде уридинмонофосфата позволяет не только нормализовать активность антиноцицептивной системы, но и устранять нейровоспалительные процессы, которые характеризуют состояние, связанное с хроническим болевым синдромом.
НУКЛЕОТИДЫ: ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Андрей Борисович Данилов, д.м.н., профессор, Москва
Нуклеотиды и, в частности, уридинмонофосфат, который содержится в Нейроуридине, прежде всего, рассматривается как соединение, способствующее нейрорегенерации. В этом процессе важнейшую роль играет шванновская клетка. Шванновская клетка выступает «дирижером» процесса нейрорегенерации. У нас не так много возможностей фармако-терапевтически помогать нервным волокнам восстанавливаться. Много говорим о витаминах, но, по крайней мере, принципиально новых данных до недавнего времени не было. Важно понять диапазон доз, действительно эффективных с точки зрения анальгезии и безопасности. Последнее, то, что я знаю: 1000 мг в сутки — это безопасно и допустимо. С моей точки, зрения анальгетический эффект не ограничивается исключительно уридинмонофосфатом. Возможно, он еще дополняется холинергическим эффектом.
ОПЫТ ПРИМЕНЕНИЯ УРИДИНОВЫХ КОМПЛЕКСОВ
Сергей Георгиевич Бурд, д.м.н., профессор, Москва
Мы проанализировали опыт применения Нейроуридина, профиль пациентов, которым чаще всего рекомендуем данный препарат, тактику наших действий. Если обсуждать пациентов, которые обращаются в Федеральный центр мозга с различными типами боли, то условно их можно разделить на несколько групп. В первую очередь, это пациенты с острой, но относительно терпимой болью. Это не сильная боль, которая не влияет на качество жизни: пациент продолжает работать, но он обратился за консультацией. У пациента отсутствует очаговая симптоматика. В основном это напряжение мышц спины, и в данной ситуации эти пациенты не хотят принимать таблетированные формы НПВС из-за риска нежелательных эффектов. Они обращаются с вопросом, какое средство принимать, что не даст побочных эффектов и не будет влиять на их работоспособность. В данной ситуации мы рекомендуем Нейроуридин. Местно применяем НПВС в течение 3–5 дней или новокаиновый пластырь. Боль достаточно быстро купируется, и через неделю пациент восстанавливается и ведет привычный образ жизни.
Следующая группа пациентов — с выраженным болевым синдромом, ограничивающим повседневную активность. Главная цель — купирование боли. Назначаются НПВС и/или центральные миорелаксанты, новокаиновый пластырь. Все зависит от симптоматики. Этой категории пациентов также рекомендуется Нейроуридин. В такой ситуации назначаем Нейроуридин иногда даже на более длительный срок — 20–40 дней. В комплексной помощи таким пациентам достигается выраженный противоболевой эффект. Мы используем данный препарат и для улучшения восстановления нервных волокон. Следующая группа — это пациенты с хронической болью и те лица, которые обратились к нам за госпитализацией или консультацией по поводу обострения боли. Часто это пациенты пожилого возраста с различными видами боли, принимающие в комплексной терапии противоэпилептические препараты, антидепрессанты. У них наблюдаем в осенний, весенний периоды синдром «ускользания эффекта», когда произошло обострение, усилилась боль либо боль возобновилась, если ее не было после ремиссии. Следует быстро помочь пациенту — предлагаем ему прием 3–5 дней НПВС и Нейроуридина в течение 20 дней. Важно отсутствие симптоматики de nova. Следующая группа — пациенты с хроническим болевым синдромом на этапе подбора терапии. В данной ситуации в качестве вторичной профилактики хронического болевого синдрома, а также пока не достигнут эффект от подбираемой терапии, пациентам при выписке также назначается курс Нейроуридина.
ОСОБЕННОСТИ МЕХАНИЗМА ДЕЙСТВИЯ НЕЙРОУРИДИНА
Василий Владимирович Афанасьев, д.м.н., профессор, Санкт-Петербург
Целесообразность включения Нейроуридина в качестве важного вспомогательного компонента при лечении болевых синдромов (боль в спине и др.) обеспечивается: собственным противоболевым действием, структуризацией мембран, необходимой для действия синаптотропных препаратов; синтезом миелина; участием в биотрансформации препаратов, использующих уридин.
На ранних стадиях поражения нервов усиливается поглощение уридина и цитидина. При болевом синдроме НПВС снижают концентрацию нативного уридина как за счет самого поражения нерва, так и за счет потребления уридина при биотрансформации НПВС. Это первый аргумент в пользу того, что Нейроуридин должен быть назначен с НПВС. Второе, уридинмонофосфат — АНТИНОЦИЦЕПТИВНЫЙ ко-трансмиттер и участник синтетических процессов в холинергических системах. Третье: уридинмонофосфат — участник синтетических процессов в дофаминергических системах, в результате чего улучшается настроение. Нейроуридин может назначаться совместно с антидепрессантами. Четвертое: компоненты Нейроуридина — аллостерические эффекторы антиноцицептивных систем. И, наконец, уридинмонофосфат — участник синтеза миелина (мембранный цикл Кеннеди), ЧТО НЕМАЛОВАЖНО ПРИ ХРОНИЗАЦИИ БОЛИ.
ВОЗМОЖНОСТИ РАСШИРЕНИЯ СПЕКТРА ПРИМЕНЕНИЯ НЕЙРОУРИДИНА
Евгений Робертович Баранцевич, д.м.н., профессор, Санкт-Петербург
Нуклеотид уридинмонофосфат — главный действующий компонент Нейроуридина, сигнальная молекула пуринергической системы. Эффекты уридинмонофосфата обусловлены активацией Р2Y пуринергических рецепторов. Сегодня мы говорим о боли, но следует рассмотреть уридин и когнитивные функции. Уридин улучшает обучение и память несколькими способами: стмулирует рост новых синапсов в головном мозге, усиливает передачу сигналов между нейронами и способствует образованию ацетилхолина. Кроме того, уридин оказывает влияние на дофаминергическую систему. Экспериментальные работы свидетельствуют о том, что пищевые добавки уридин‑5‑монофосфата увеличивают вызванное калием высвобождение дофамина и способствует росту аксонов у старых крыс. Уридин считается одним из естественных способствующих сну веществ, вырабатываемых мозгом, действующих через уридиновые рецепторы в областях мозга, которые регулируют сон. Поэтому во время дискуссии мне хотелось обратить внимание на возможность использования Нейроуридина при диссомниях.
ПУРИНЕРГИЧЕСКАЯ СИСТЕМА В РЕГУЛЯЦИИ БОЛИ
Александр Витальевич Амелин, д.м.н., профессор, Санкт-Петербург
Рекомендации, которые сегодня представлены на сайте РОИБ по лечению неспецифической боли в спине, предполагают мультимодальный подход к терапии боли. Воздействие на разные патогенетические механизмы приводят к более эффективному купированию боли. Система ЦОГ: применение НПВП приводит к блокаде синтеза простагландинов за счет подавления фермента циклооксигеназы, в результате подавляются боль и воспаление.
Пуринергетическая система: применение нуклеотидов (Нейроуридин) — активация противовоспалительных и антиноцицептивных эффектов пуринергической системы. Синергия двух систем купирования боли обеспечивает максимальный противоболевой эффект. Возможны следующие эффективные и безопасные комбинации для лечения невропатической и ноцицептивной боли.
Невропатическая боль: антиконвульсант + Нейроуридин; антидепрессант + Нейроуридин; местный анестетик + Нейроуридин; капсаицин + Нейроуридин.
Ноцицептивная боль: НПВП + Нейроуридин; неопиоидный анальгетик + Нейроуридин; Опиоидный анальгетик + Нейроуридин; центральный релаксант + Нейроуридин.
НЕВРОПАТИЧЕСКАЯ БОЛЬ: ДОКАЗАТЕЛЬСТВА ЭФФЕКТИВНОСТИ ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ
Олег Сергеевич Давыдов, к.м.н., Москва
Монотерапия позволяет добиться успеха в лечении невропатической боли только у 30 % пациентов. Не вызывает сомнений, что Нейроуридин в качестве дополнительного средства при невропатической боли работает. В большом исследовании на фоне использования уридинсодержащего комплекса пациенты с невропатической болью получали различные препараты, в том числе антиконвульсанты, НПВП и другие, у многих удалось добиться либо снижения дозы основного препарата, либо его отмены. Серьезных исследований при хронической боли в спине я не встречал. Но в целом перспектива есть.
ФАРМАКОРЕЗИСТЕНТНЫЕ РАДИКУЛОПАТИИ: РАЗБИРАЕМСЯ, ЛЕЧИМ
Дмитрий Анатольевич Искра, д.м.н., профессор, Санкт-Петербург
Мы обсуждаем боль в спине. Каких пациентов мы с вами лечим — тех, которые к нам первично обращаются, или тех, которые приходят к нам раз за разом, месяц за месяцем? Я говорю не о пациентах с хронической болью. Я говорю о пациентах с болью рецидивирующей. Печальные цифры свидетельствуют, что, по сути, проблема боли в спине — проблема терапии одних и тех же больных, у которых почему-то наблюдаются рецидивы. Боль прошла, а воспаление осталось. Складывается впечатление, что у пациентов с рецидивирующей болью именно эта история. Нейроуридин предполагает возможность влияния на эту ситуацию. Много говорили о влиянии пуринергических рецепторов на факторы системного воспаления. Это, по сути дела, «заход» на обезболивающее действие с другой стороны. При рецидивирующей боли назначение Нейроуридина должно быть показано.
ВЗГЛЯД ГЕРИАТРА
Антон Вячеславович Наумов, д.м.н., профессор, Москва
Хроническая боль — самое распространенное патологическое состояние у пациентов пожилого возраста. Более 72 % пожилых жалуются на боль в спине. Среди них каждый пятый имеет невропатическую боль (при оценке шкалы DN4). Наличие невропатической боли для возрастных пациентов — это существенное увеличение количества и тяжести гериатрических синдромов, которые влияют и на прогноз заболевания, и на качество жизни. По сути, целый ряд гериатрических синдромов являются симптомами невропатии. С другой стороны, установлено, что более 70 % пожилых пациентов ежедневно или минимум 3 раза в неделю получают при хронической боли только нестероидные противовоспалительные препараты. Это повышает риски и затраты на лечение боли. Сегодня уридин исследуется с разных точек зрения, но в гериатрической практике больше импонирует то, что снижение уровня уридина оказалось маркером развития старческой астении. Это то состояние, которое резко ухудшает самочувствие пожилых людей, поэтому применение уридина у пациентов старческой группы является весьма важным.
Андрей Петрович Рачин, д.м.н., профессор, Москва
Большое количество исследований показывают перспективность этой молекулы. Сегодня уже обсуждался вопрос: это препарат анальгетического плана или средство, которое обладает антиоксидантным свойством и оказывает ремиелинизирующий эффект? Мы говорим о том, что это препарат с различными механизмами действия и на пуринергичеческую систему, и на регенерацию. Во многом эти эффекты будут определяться и продолжительностью приема. Следующий важный вопрос — это зависимость эффекта от дозы.
МЕСТО ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ В ПРАКТИКЕ НЕВРОЛОГА
Максим Валерьевич Чурюканов, к.м.н. Москва
Эффекты уридинмонофосфата, которые сегодня наблюдаем, которые обсуждаются с разных позиций, в целом могут быть сгруппированы следующим образом. Первый взгляд — теоретические суждения на предмет возможного влияния на те или иные состояния в центральной нервной системе. С другой стороны, мы пытаемся найти клинические подтверждения такого рода рассуждениям. Немало исследований проведено в отношении эффективности уридинмонофосфата в комплексной терапии у пациентов с невропатической болью. Клинические исследования подтверждают целесообразность сочетанной терапии НПВП и уридином при боли в спине и шее. Холин совместно с пиримидиновыми нуклеотидами повышает эффективность лечения. Нейроуридин можно рассматривать в качестве дополнительного средства лечения пациентов с острой болью в спине.
НЕЙРОУРИДИН. НАСТОЯЩЕЕ И БУДУЩЕЕ
Эдуард Закирзянович Якупов, д.м.н., профессор, Казань
На сегодняшней встрече мы говорим о настоящем, но думаем и о будущем. Мы быстро продвигаемся вперед: только вчера обсуждали, что будем делать с этой молекулой, сейчас обсуждаем итоги и то, как будем развиваться дальше. Многомерность комплекса Нейроуридин провоцирует нас на то, что мы ищем разные новые подходы по его использованию. Боль — номер один в системе медицины. Мы понимаем, что возможности у этого комплекса намного шире. Мы могли бы акцентировать внимание только на боли, но Нейроуридин — это комплекс, который способствует восстановлению нервов. Средств, которые помогают восстановиться нервным волокнам, на самом деле очень мало. Нейроуридин относится к этой немногочисленной группе средств.
ОПЫТ ПРИМЕНЕНИЯ ПИРИМИДИНОВЫХ НУКЛЕОТИДОВ В ПРАКТИКЕ ВРАЧА-НЕВРОЛОГА В РЕСПУБЛИКЕ КАЗАХСТАН
Еркын Смагулович Нургужаев, д.м.н., профессор, Алматы
Применение физиологических пиримидиновых нуклеотидов оправданно считается одним из перспективных направлений при лечении больных с дорсопатиями.
В заключение совета экспертов все участники поддержали создание странички «Пуринергический клуб» на сайте «Российское межрегиональное общество по изучению боли» (РОИБ) — www.painrussia.ru, которая будет содержать все актуальные сведения о деятельности пуринергической системы и ее роли в контроле боли.
Место пиримидиновых нуклеотидов в практике лечения боли. Результаты консенсуса международной группы специалистов
А.В. Амелин, В.В. Афанасьев, Е.Р. Баранцевич, С.Г. Бурд, М.А. Григолашвили, О.С. Давыдов, А.Б. Данилов, Н.А. Жаркинбекова, Д.А. Искра, М.Л. Кукушкин, А.В. Наумов, Е.С. Нургужаев, А.П. Рачин, М.В. Чурюканов, Э.З. Якупов
«Российский журнал боли №1 (21) 2023»Клинико-фармакологическое обоснование новых направлений патогенетической терапии диабетической полинейропатии
Д.А. Искра, д.м.н., проф., В.В. Афанасьев, д.м.н., проф.,А.Р. Волкова, д.м.н., проф.
«Эффективная фармакотерапия №10 (18) 2022»Оценка эффективности и безопасности нейропротективного комплекса «Нейроуридин» у пациентов с болью в спине
Э.З. Якупов, Ю.В. Трошина, Р.Р. Гайнутдинова, А.О. Кашапова
«Журнал неврологии и психиатрии им. С.С. Корсакова №6 (121) 2021»Уридин и холин оказывают синергичный нейрорегенеративный и нейропротективный эффект при нарушениях когнитивных функций
Barry S. Baumel, P. Murali Doraiswamy, Marwan Sabbagh and Richard Wurtman
Neurol Ther. 2021 Jun; 10(1): 43–60. doi: 10.1007/s40120-020-00227-yPotential Neuroregenerative and Neuroprotective Effects of Uridine/Choline-Enriched Multinutrient Dietary Intervention for Mild Cognitive Impairment: A Narrative ReviewФрагмент публикации:
Преклинические эксперименты показали, что введение уридина с другими ключевыми субстратами (холином и ДГК) стимулируют нейрорегенерацию, увеличивая продукцию синаптических белков, образование синапсов, а также уровень нейротрансмиссии, что, в свою очередь, может привести к улучшению производительности памяти. Доклинические эксперименты также показали, что введение уридина может обеспечивают нейропротекцию, о чем свидетельствуют уменьшение нейродегенерации. Обратите внимание, что эти нейропротекторные эффекты наблюдались при введении уридина с другими питательными веществами, включая холин и ДГК.
Имеются данные полученные в клинических условиях, что введение уридина может иметь положительное влияние на когнитивные функции. Контролируемое исследование с участием 17 здоровых добровольцев показало, что введение уридина увеличивает мозговые предшественники мембранных фосфолипидов (измеренных с использованием магнитно-резонансной спектроскопии 31-фосфора [МРС]).
Резюме:
При легких когнитивных расстройствах (ЛКР), вызванных болезнью Альцгеймера (БА), также известных как продромальная БА, имеются данные о патологической нехватке уридина, холина и докозагексаеновой кислоты (ДГК), которые являются ключевыми веществами, необходимыми мозгу.
Доклинические и клинические данные показывают важность биодоступности питательных веществ для поддержки развития и поддержания структуры и функций мозга при ЛКР и БА. Доступность ключевых питательных веществ при ЛКР ограничена, что создает особую потребность в уридине, холине и ДГК.
Имеющиеся данные свидетельствуют о том, что метаболические нарушения, связанные со старением и патологиями, связанными с болезнями, могут влиять на способность организма вырабатывать и использовать питательные вещества. Это отражается на более низких уровнях питательных веществ, измеренных в плазме и мозге людей с УКР и БА, а также ассоциируется с прогрессирующей потерей когнитивных функций.
Дефицит уридина не может быть компенсирован обычной диетой, что делает уридин условно незаменимым питательным веществом для больных людей. Также сложно восполнить дефицит холина только с помощью диеты, поскольку поглощение мозгом из плазмы значительно снижается с возрастом. Нет убедительных доказательств в поддержку использования монокомпонентных добавок при лечении ЛКН, вызванных БА. Поскольку уридин и холин действуют синергично с ДГК, увеличивая образование фосфатидилхолина, существует убедительное обоснование для объединения этих питательных веществ.
Мультинутриент, обогащенный уридином, холином и ДГК, разработанный для поддержки функции мозга, был оценен в рандомизированных контролируемых исследованиях, охватывающих спектр нарушений от ЛКР до умеренной БА. Рандомизированное контролируемое исследование с участием пациентов с продромальной БА показало, что мультинутриентное вмешательство замедляет атрофию мозга и улучшает некоторые показатели когнитивных функций.
Основываясь на имеющихся клинических данных, диетологическое вмешательство следует рассматривать как часть подхода к ведению пациентов с ЛКР, включая соблюдение здорового, сбалансированного питания и рассмотрение научно обоснованных полинутриентных добавок.
Результаты открытого наблюдательного исследования по оценке мультимодальных эффектов и безопасности БАД Нейроуридин у пациентов с неспецифической болью в спине (МУЛЬТИНЕЙРО-1)
Э.З. Якупов, Ю.В. Трошина, А.О. Кашапова, А.М. Насрыева, Р.С. Чиж
«Журнал неврологии и психиатрии им. С.С. Корсакова №9 (120) 2020»Пуринергические механизмы боли и обезболивания
М.Л. Кукушкин, В.К. Решетняк
«Российский журнал боли №1 (17) 2019»

